ESTIMACIÓN DE LA ENERGÍA
DE ACTIVACIÓN EN LA DISOLUCIÓN DE COMPRIMIDOS EFERVESCENTES
![]() Introducción:
Introducción:
Muchos
medicamentos, como aspirina, vitamina C o antiácidos, entre otros, se presentan
en forma de comprimidos efervescentes que se disuelven rápidamente en agua.
Normalmente estos comprimidos contienen ácido cítrico (o ácidos similares) y
bicarbonato sódico, como excipiente efervescente. Al introducirlo en agua, el
comprimido se disuelve desprendiendo CO2 (g):
Medicamento (s) + NaHCO3
(s) + ácido cítrico (s) H2O ® Medicamento (ac) +
+ CO2 (burbujas de gas) + Citrato sódico (ac)
Considerando
que el tiempo, t, necesario para completarse una reacción, es inversamente
proporcional a la constante de velocidad, k, la ecuación de Arrhenius,
k=A·exp(-Ea / R·T), se puede expresar de la forma:
Ln
t = C + Ea / R·T
Donde C es
una constante que incluye -ln A y la constante de
proporcionalidad.
El proceso
global, cuya cinética viene limitada por la velocidad de disolución de los
sólidos implicados (y que está controlada a su vez por difusión) se puede
representar de forma simplificada por los pasos:
H2O
NaHCO3 (s) ® NaHCO3 (aq)
NaHCO3 (aq) ® Na+ (aq) + HCO3-
(aq)
H2O
R-COOH (s) ® R-COOH (aq)
R-COOH
(aq) ® R-COO-
(aq) + H+ (aq)
H+ (aq) + HCO3-
(aq) ® H2CO3
(aq)
H2CO3 (aq)
® CO2 (aq) + H2O (l)
CO2 (aq)
® CO2 (g)
![]() Desarrollo experimental:
Desarrollo experimental:
En el
experimento que se propone, se deberá medir el tiempo que tarda en disolverse
un comprimido efervescente en un determinado volumen de agua, a diferentes
temperaturas. Una representación lineal de ln t
frente a 1/T permitirá obtener Ea/R como
pendiente, y con ello la Ea (energía de
activación aparente) del proceso global, cuya cinética viene limitada
esencialmente por la disolución de sólidos.
Se propone
tomar datos experimentales a temperatura ambiente (» 22ºC),
en frigorífico o en agua con hielo (» 4 ºC) y con agua caliente (» 60 ºC).
Sería conveniente (pero no es estrictamente necesario) disponer de termómetro.
Se debería
indicar en cada caso: tipo de comprimido (marca y, si se ofrece en prospecto,
composición del excipiente efervescente), procedimiento experimental,
resultados y, finalmente, Ea en kJ/mol.

Figura 1.
Dispositivo experimental.
![]() Resultados:
Resultados:
En la
figura 2 se muestra una gráfica con los resultados obtenidos en el laboratorio,
considerando 13 experimentos con comprimidos de Couldina.
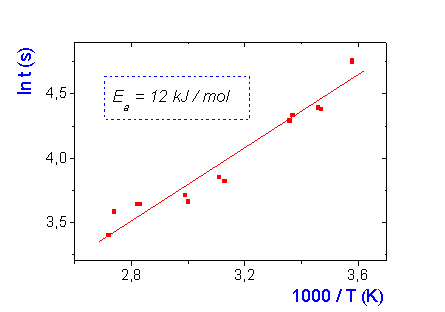
Figura 2. Ejemplo de resultados
obtenidos en el laboratorio.
Aparte del
valor obtenido en el Laboratorio para la energía de activación global en la
disolución de comprimidos de Couldina (Ea = 12 ± 1 kJ/mol), algunos resultados típicos obtenidos por grupos de
alumnos en su casa, fueron los siguientes:
Comprimido
efervescente Energía de
activación (kJ/mol)
Alka Seltzer 12 ± 1
Vitamina C 14 ± 2
Efferalgan Efervescente 17 ± 3
Redoxón 23
± 2
Calcium Sandoz Forte D 25 ±
3
Otra
alternativa es que se preparen comprimidos efervescentes comprimiendo NaHCO3 y ácido cítrico (tartárico, succínico,
etc.) en polvo.
![]() Bibliografía:
Bibliografía:
G. Pinto, “Experimenting with a fizzy tablet”, Education
in Chemistry, Vol. 37, pp. 71, 81.