Prof. José Ignacio Zubizarreta
Dr. Ingeniero Industrial
Al representar los datos del logaritmo del tiempo de
desaparición de una tableta efervescente disuelta en agua con la inversa de la
temperatura absoluta se calcula una energía de activación al suponer que el
proceso sigue una evolución exponencial con la temperatura siguiendo la
ecuación de Arrhenius.
El proceso de neutralización
de la reacción ácido-base y consecuente generación del CO2 por sobresaturación
en el agua es un proceso muy rápido, conocido, en las operaciones de
transferencia de materia con reacción química, como de “reacción instantánea”,
limitada solamente por la difusión de los reactantes (Sherwood
& Pigford; Absortion and Extraction, 1951 McGraw-Hill) (Astarita; Mass transfer with
Chemical Reaction ,1967 Elsevier).
Antes de que se realice la
neutralización y se desprenda el CO2 los sólidos se tienen que
disolver y el proceso de su disolución es mucho más lento que la reacción
ácido-base. Por consiguiente lo que se mide en realidad es la cinética de la
disolución de los reactivos y su dependencia con la temperatura. Es decir un
proceso puramente físico y no químico. El concepto de energía de activación no
suele aplicarse a la disolución de sólidos.
La difusión de un soluto que
se transporta en un líquido en su dependencia de la temperatura sigue la
ecuación de Stokes-Einstein
que ha sido modificada por Wilke y Chang (Sherwood, Pigford, Wilke; Mass Transfer, 1975 McGraw-Hill), en donde entre otros parámetros resulta
proporcional a la temperatura e inversamente proporcional a la viscosidad. En
general según indica el Perry (J.H.
Perry & Chilton; Chemical Engineer’s Handbook, 1973, McGraw-Hill) se
puede decir que definidos el soluto y el fluido:
![]() constante
constante
donde DAB es la difusividad del soluto A en el líquido B, μ es la
viscosidad del líquido B y T es la temperatura absoluta.
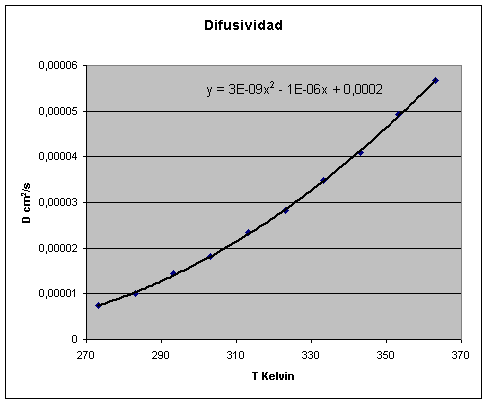
En el caso del agua y el
bicarbonato tomando DAB igual a 1,5·10-5 cm2/s
como valor típico de referencia a 25 ºC la
correlación que se obtiene con la temperatura al aplicar las correcciones por
la viscosidad del agua en dependencia a su vez con la temperatura y según la
relación anterior resulta una expresión cuadrática para DAB y se
representa su evolución en la figura que sigue.
El flujo medio que se
obtiene al integrar la ecuación de Fick en una placa
a un medio semiinfinito por la teoría de la
penetración, para un tiempo de disolución t (Sherwood,
Pigford, Wilke; Mass Transfer)
:
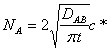
donde NA es el flujo
medio de transporte en kmol/m2s, DAB
es la difusividad del soluto A en el disolvente B y
c* es la concentración de saturación en la interfase. Se considera que la
concentración c del soluto en todo momento en el conjunto del líquido es cero
al ionizarse y reaccionar instantáneamente el reactante disuelto.
En el caso que nos ocupa NA
es la masa en moles de reactante inicial dividida por la superficie de la
pastilla y por el tiempo t hasta su disolución: NA = M/St
Por lo tanto despejando 1/t ≈ DAB·(c*)2
siendo el resto constantes.
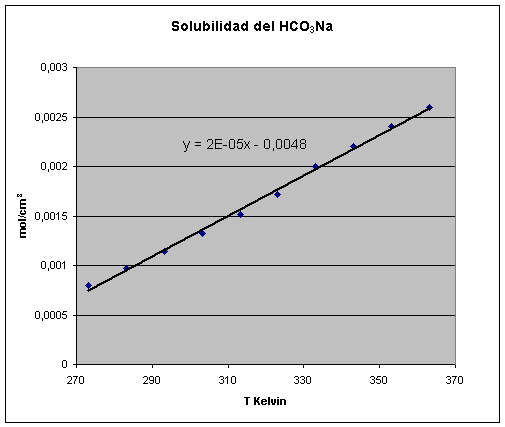
La concentración de
saturación c* es una función lineal de la temperatura como se puede ver en la
gráfica a continuación donde se presentan los datos obtenidos para el
bicarbonato sódico de las International Critical Tables (ICT).
Las mismas tablas (ICT Vol.
5) dan valores de la cinética y del efecto de la temperatura de la solución de
sales en agua y ácidos, con valores de un incremento del 10 al 50% en la
velocidad por cada 10 ºC de elevación de temperatura.
En la experiencia se obtienen valores similares (10-35%) lo que determina una
vez más que lo que se está midiendo es la velocidad a la que la tableta se
disuelve.
Por consiguiente, de la
expresión anterior se desprende que al representar 1/t con respecto a la
temperatura en grados Kelvin resultará una ecuación polinómica
de 3º o 4º grado al desarrollar DAB·c*2,
un polinomio de segundo grado por otro de 1º al cuadrado.
Tomando los datos
experimentales de la página Web se comprueba que es así.
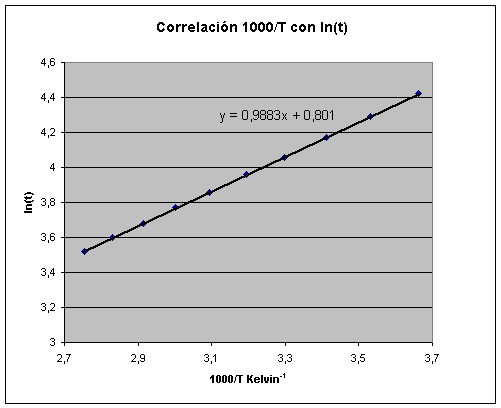
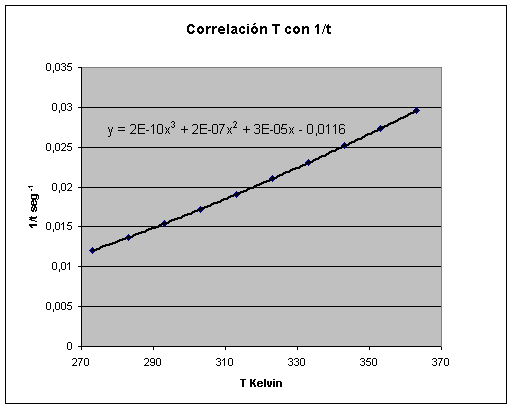
Como conclusión
puede decirse que matemáticamente se ha correlacionado aceptablemente, dentro
del rango de medida, los datos experimentales, a través de una función
exponencial de la inversa de la temperatura pero no se está midiendo en
realidad la cinética de una reacción química.
La verdadera
correlación sustentada por la teoría es la representación del inverso del
tiempo de disolución como función polinómica de
tercer grado de la temperatura.