SOLUCIÓN AL PROBLEMA 9.1
1.-
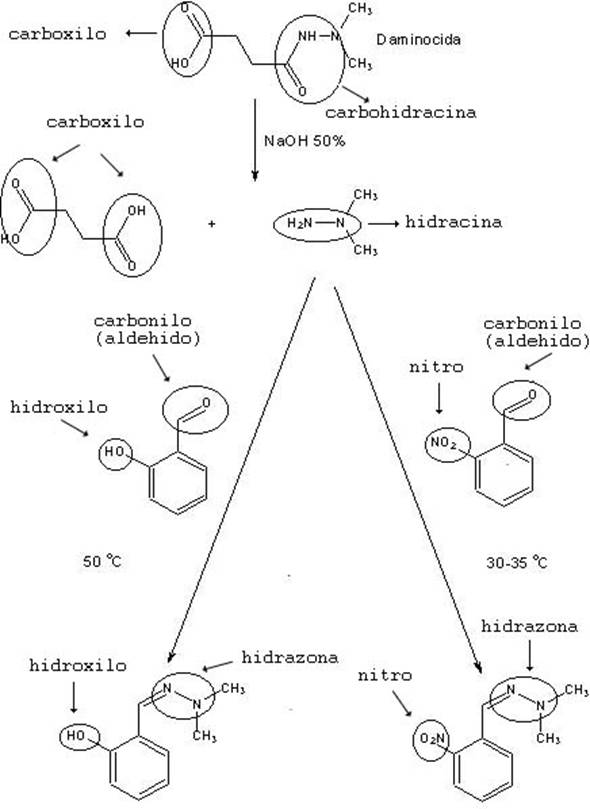
2.- La dimetil hidracina es una substancia muy polar, de bajo peso molecular y sin ningún grupo cromóforo. Todas estas características hacen de dicha substancia una mala candidata para obtener resultados satisfactorios empleando técnicas de análisis instrumental. Por otra parte, al ser una hidracina, puede reaccionar con grupos carbonilo con relativa facilidad. Esta última propiedad es la que se aprovecha para obtener un derivado que se puede analizar por GC/MS de forma satisfactoria.
3.- El primer paso es una reacción de hidrólisis del grupo carbohidracínico. Mecanísticamente es una reacción análoga a la hidrólisis de un éster, proceso que se ve muy favorecido por la existencia de una concentración elevada de grupos hidroxilo en el medio de reacción. Tales grupos se supone que actúan de nucleófilos y atacan el carbono unido a un nitrógeno y a un oxígeno (carbono del grupo carbohidracina).
4.-
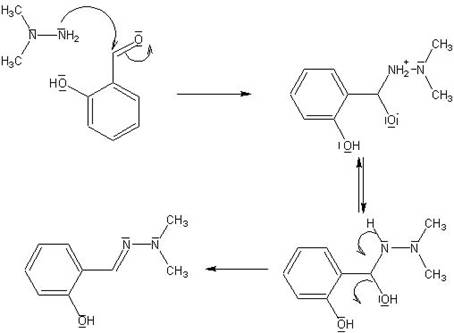
5.- Tanto el grupo nitro como el hidroxilo se encuentran unidos a la posición 2 (posición orto) del anillo aromático. Ahora bien, mientras el grupo hidroxilo es un grupo electrodador, el grupo nitro es un potente electronatrayente. El efecto de uno u otro sobre el carbono carbonílico del aldehido habrá de ser lógicamente totalmente opuesto. Así, el grupo nitro deberá aumentar de manera considerable el carácter electrófilo de dicho carbono haciendo más fácil (mayor velocidad en idénticas condiciones) el ataque por parte de la hidracina.
6.- El cloruro de titanio (III)
probablemente revierte las posibles hidrazonas que se
hayan formado, o se puedan formar, por reacción de la dimetilhidracina
libre con los azúcares reductores de la fruta, de nuevo a la forma de hidracina
libre. Se ha de tener en cuenta que la hidracina se recupera por destilación
por arrastres de vapor y es en el destilado donde se lleva a cabo la reacción
con el reactivo correspondiente para formar así la hidrazona
final. (Ver Fieser & Fieser, Reagents for Organic Synthesis V 6, John Wiley
& Sons: