SOLUCIÓN AL PROBLEMA 4.3
1.- La constante de equilibrio KP viene determinada por la expresión:
DGº = - R*T*lnKP
Por otra parte, la variación de energía libre de Gibbs en condiciones estándar (DGº) de la reacción viene dada por la relación:
DGº = DHº - T*DSº
De los datos termodinámicos que aporta el problema, se calcula:
DHº = 112 kJ/mol
DSº = 132 J/(mol*K)
Así, se tienen:
DGº (298K) = 72,66 kJ/mol. Por tanto, KP (298K) = 1,8*10-13
DGº (773K) = 9,96 kJ/mol. Por tanto, KP (773K) = 0,21
De la relación :
KP = KC * (RT)Dn, donde en este caso la variación de moles en fase gas de la reacción es +1, se llega a:
KC (298K) = 7,4*10-15
KC (773K) = 3,3*10-3
2.-
|
|
COCl2
(g) |
<---> |
Cl2
(g) |
+ |
CO (g) |
|
concentraciones en equilibrio: |
C0 (1-a ) |
|
C0*a |
|
C0*a |
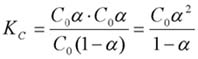
La aproximación KC » C0*a 2 no es adecuada en ninguno de los dos casos que plantea el problema. Resolviendo las correspondientes ecuaciones cuadráticas, se obtiene:
2.1.- Si C0 = 1,0 M entonces, a = 0,056 , se descompone el 5,6%.
2.2.- Si C0 = 1,0*10-4 M entonces, a = 0,97 , se descompone el 97%.
3.1.- Si aumenta la temperatura, el equilibrio se desplaza hacia la derecha, porque la reacción es endotérmica (DHº> 0). Se comprueba por ejemplo por el aumento de la constante de equilibrio calculado en el apartado 1, al pasar de 25ºC a 500ºC.
3.2.- Si aumenta la presión, el equilibrio se desplaza hacia la izquierda, porque así disminuye el número de moles en fase gas.