Analogía para meditar sobre la diferencia entre carga formal y número de oxidación
Una
manera de evaluar la distribución de cargas eléctricas cuando se unen átomos
por enlace covalente (formando moléculas o iones poliatómicos)
es mediante la asignación de cargas, una vez establecida la estructura de Lewis (representación de los electrones de valencia
compartidos y solitarios), siguiendo dos métodos arbitrarios:
·
Cargas formales: los electrones solitarios pertenecen sólo al átomo que los
posee y los compartidos pertenecen por igual a los átomos enlazados.
·
Números de oxidación: los electrones solitarios pertenecen sólo al átomo que
los posee y los compartidos pertenecen por sólo al átomo más electronegativo de
los dos enlazados.
En
ambos casos, la carga eléctrica viene dada por el número de electrones de
valencia del átomo aislado menos el número de electrones de valencia del átomo
siguiendo los métodos citados.
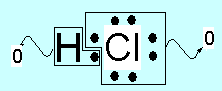
De
esta forma, por ejemplo, en la molécula de HCl, las
cargas formales valen 0 para los dos átomos (1-1 y 7-7, respectivamente) y los
números de oxidación son +1 (1-0) y –1 (7-8), según se representa en los
siguientes esquemas:
|
|
|
|
|
|
En
cualquiera de los dos casos, debe entenderse la filosofía última de asignación
de cargas. En el caso del átomo de hidrógeno, se evalúa la carga de un átomo
que, con un protón (carga positiva) en su núcleo, tiene 1 ó 0 (según los
métodos anteriores) electrones (carga negativa). De igual manera, la carga del Cl se debe entender evaluando que posee 17 protones (su
número atómico) y, bien 17 electrones (método de cargas formales), bien 18
electrones (método de números de oxidación). El ejemplo del Cl
viene bien para comprender que, aunque se representan
y se consideran en el cálculo sólo los electrones de valencia, hay otros
electrones internos.
Los
dos métodos son, como se ha señalado, procedimientos arbitrarios. El primero de
ellos es una herramienta importante, por ejemplo, para evaluar las formas
canónicas que mejor explican la resonancia. El segundo es de interés para
interpretar correctamente las reacciones químicas de oxidación-reducción.
Finalmente,
y es quizá el objetivo fundamental de la analogía que se discute aquí: ¿cuáles
son las cargas reales de los átomos en la molécula de HCl?. La respuesta es: ni las que se predicen mediante
asignación de cargas formales ni las que se predicen por el método de número
oxidación, sino valores intermedios. Así, en el H será entre 0 y +1 y en el Cl será entre 0 y –1. Es así porque la distribución real de
carga no es tan tajante como los dos métodos seguidos: en el primero se supone
que se comparten por igual los electrones compartidos y en el segundo método se
entiende que el más electronegativo es el que “se los lleva”.
Este
último razonamiento es el que me lleva a compararlos con lo que podrían ser (a
nivel de caricatura) los sistemas económicos comunista (se comparte por igual)
y capitalista (el más poderoso se lleva todo lo que se podría compartir):
|
|
Cargas formales
|
|
|
Números de oxidación |
Para
recordar pnemotécnicamente el método, se puede
considerar que la C de cargas formales es precursora de una hoz ( Ϛ
).