Introducción
Introducción
A muchos niños les llama la atención
cuando se colocan, especialmente al llegar el verano, unas “misteriosas” bolas
blancas (sueltas o en bolsas), con olor característico, entre la ropa. Cuando
preguntan, se les suele decir que son “bolas de naftalina” para ahuyentar las
polillas. Al cabo del tiempo, desaparecen las bolas sin dejar rastro. Es un
ejemplo que se emplea a menudo por los profesores para ilustrar el fenómeno de
la sublimación. Aquí se sugieren unas cuestiones sobre las sustancias empleadas
como repelentes de polilla y se ofrece información al respecto. El objeto es
disponer de una herramienta educativa más para favorecer el pensamiento crítico
en los alumnos de Química
Polillas de ropa
Hay muchas más especies de polillas
que de mariposas. De hecho, casi el 95% de los lepidópteros son polillas. La
subdivisión se basa en las diferencias de estilo de existencia: las mariposas
son activas durante el día y las polillas durante la noche. Afortunadamente, de
las miles de especies de polillas sólo unas pocas se desarrollan en los
armarios donde se guarda la ropa.
Las polillas de ropa se desarrollan
mediante un ciclo completo de metamorfosis: huevo, estado de larva, capullo y
adulto (polilla). Sin embargo, es el estado larvario el que daña a los tejidos
(ver Figura 1). Los adultos son inofensivos en ese aspecto, pero la larvas
pueden digerir la queratina contenida en materiales orgánicos como lana,
pieles, plumas, seda, etc. Son de los pocos organismos que pueden digerir la
queratina, una proteína estructural producida por los animales.

Figura 1.
Efecto del ataque de las larvas de polillas en la ropa (Copyright ©
Missouri Conservation Commission).
Cuando
comienza el ciclo de las polillas, el adulto pone entre 100 y 150 huevos de unos
0,01 cm de longitud. Al abrirse el huevo, al cabo de unos cinco días, la larva
va creciendo, hasta medir del orden de 1,2 cm, alimentándose de tejido.
Normalmente empieza a alimentarse en zonas donde hay restos de bebida o comida.
Este proceso dura de dos a tres meses, y es la causa del daño que producen las
polillas a los tejidos. Pasado ese proceso, preparan el capullo del que saldrá
la polilla adulta, que vive menos de tres meses. Las polillas de ropa no suelen
volar a la luz durante la noche, prefiriendo la oscuridad. Son comidas por
pájaros, ranas, tortugas y pequeños mamíferos. En la Figura 2 se muestran dos
tipos de polilla de ropa y sus larvas correspondientes.

Figura 2.
Polillas adultas (con alas) y sus correspondientes larvas (Copyright © Missouri
Conservation Commission).
La ropa dañada por polillas es
difícil de reparar porque el tejido ha sido digerido. El mayor daño se produce
en tejidos no tratados ni cuidados durante largo tiempo, como mantas o viejos
uniformes.
Cuestiones y respuestas
Se
proponen una serie de cuestiones para que los alumnos aprendan y se pregunten
sobre la química de los productos antipolillas y otros temas relacionados.
Cuestión 1. Buscando en
Internet, en libros de Química o en la información suministrada en los prospectos
y envoltorios de productos antipolillas comerciales, indicar los nombres y
formulas químicas de las sustancias más comúnmente utilizadas en el hogar como
repelentes de polillas.
Respuesta.
Algunos productos químicos utilizados como repelentes de polillas son:
naftaleno (a veces denominado con el nombre antiguo de naftalina),
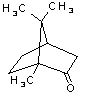
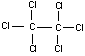
p-diclorobenceno (o 1,4-diclorobenceno), alcanfor (una terpenocetona bicíclica)
y hexacloroetano (o 1,1,1,2,2,2- hexacloroetano). Las formulas químicas y
estructurales de estos compuestos se muestran en la Tabla 1. El alcanfor ha
sido utilizado para ahuyentar a las polillas desde tiempos históricos. Después
del uso de la “naftalina”, cada vez se usa más el p-diclorobenceno. El
hexacloroetano ha tenido un uso más limitado.
Tabla 1.
Algunas sustancias características empleadas como repelentes de polillas.
|
Sustancia antipolilla |
Fórmula estructural |
Fórmula química |
Peso molecular (g/mol) |
Punto de fusión (ºC) |
Punto de ebullición (ºC) |
|
Naftaleno |
|
C10H8 |
128,2 |
80 |
218 |
|
1,4-diclorobenceno |
|
C6H4Cl2 |
147,0 |
53 |
175 |
|
Alcanfor |
|
C10H16O |
152,2 |
178 |
204 |
|
Hexacloroetano |
|
C2Cl6 |
236,7 |
187 (sublima) |
|
Cuestión 2. Justificar, de
acuerdo con el tipo de fuerzas intermoleculares predominante, por qué los
productos antipolilla son sólidos que subliman y tienen un olor penetrante
característico.
Respuesta. Los
cuatro compuestos citados tienen en común que, a temperatura ambiente, son
sólidos que subliman fácilmente. Expuestos al aire, se transforman lentamente
en gas. De hecho, es ese gas el que hace de repelente por ser tóxico para las
polillas. Estas sustancias presentan fuerzas intermoleculares débiles,
predominando las de tipo London, por ser apolares, excepto en el alcanfor,
donde predominan fuerzas de dipolo-dipolo. En todos los casos, los puntos de
fusión y ebullición (ver Tabla 1) son bajos, en comparación con los valores
típicos de los sólidos más comunes. El olor característico es apreciable por la
evaporación que se produce. Por ello también se usan en productos odorizantes.
Cuestión 3. Buscar las
presiones de vapor de los sólidos utilizados como antipolillas, a 25 ºC, y
compararlas con las de otros sólidos.
Respuesta.
En manuales adecuados de datos químicos y físicos de sustancias, se dan los
valores de presión de vapor de varios sólidos, en función de la temperatura. El
concepto de presión de vapor es difícil de entender para los alumnos, no solo
para sólidos, sino también para líquidos. Esto hace especialmente útiles este
tipo de cuestiones. El concepto de presión de vapor es además esencial para
entender cuestiones como los diagramas de fases. Los valores obtenidos de
presión de vapor a 25 º C (298 K) para las cuatro sustancias antipolillas
citadas y para el hierro y cobre, tomados como ejemplos de otros sólidos que
son comunes para los alumnos, se recogen en la Tabla 2. Se observa que en el
caso de los productos antipolillas, las presiones de vapor son varios órdenes
de magnitud mayores que en sólidos
habituales.
Tabla 2.
Presiones de vapor, a 25 ºC, de sólidos utilizados como repelentes de polillas
y dos metales típicos utilizados para comparar.
Sustancia Presión
de vapor a 25 ºC (mm Hg)
Naftaleno 0,2
1,4-diclorobenceno 1,0
Alcanfor 0,3
Hexacloroetano 0,5
Cobre ~10-50
Hierro ~10-62
Cuestión 4. Pesar una
bola de antipolilla nada más abrir su bolsa y después de una hora. Estimar la duración
de dicha bola y comparar el valor de duración estimada con el ofrecido por el
fabricante en la información del producto.
Respuesta. El
hecho de que estas sustancias volatilizan apreciablemente a temperatura
ambiente se puede observar por pesada. En una hora (tiempo de una clase), se
puede apreciar que una bola de antipolilla pasa de pesar 4,788 g a (después de
una hora en la ventana) pesar 4,667 g en una hora. Sin considerar la reducción
de tamaño, se puede pensar que desaparecerá en menos de dos días.
Experimentalmente es fácil comprobar que, es esas condiciones, desaparece en
pocos días. Sin embargo, el fabricante suele indicar que ese tipo de productos
permiten el control de las polillas durante meses. Obviamente, la diferencia
está en que los antipolillas se guardan entre la ropa, en armarios cerrados,
donde el ambiente está saturado del vapor del antipolilla y la evaporación es
más lenta que expuesta a un ambiente abierto, donde no se da saturación.
Más sobre el tema
Las cuestiones
propuestas tienen respuestas abiertas, pudiéndose encontrar otras cuestiones
químicas interesantes. Por ejemplo, en la caja de un producto antipolilla se
puede leer que “su formulación, sin naftalina ni p-ciclorobenceno, es muy útil
contra las polillas, sin olores persistentes ni productos químicos”. Lo
curiosos es que, en la composición, se indica que contiene un 0,095 % de
permetrina. ¿Eso no es un producto químico?.
Hoy en día,
aparte de los cuatro productos citados en las cuestiones previas, se utilizan
como antipolillas insecticidas como permetrina o empentrina. Ambos son
piretoides (derivados semisintéticos de las piretrinas), prácticamente inodoros
y con alta eficiencia en la destrucción de insectos y baja toxicidad sobre
mamíferos, en comparación con otras sustancias. Actúan contra las polillas en
todas sus fases (huevo, larva y adulto). Las piretrinas son insecticidas
naturales producidos por ciertos tipos de plantas (crisantemos) que actúan como
un veneno que penetra rápidamente en el sistema nervioso del insecto.
En este punto, se
puede utilizar este tipo de compuestos para utilizar la formulación orgánica.
La permetrina, con la fórmula C21H20Cl2O3,
es el nombre común del
3-fenoxibencil(1RS)-cis,trans-3-(2,2-diclorovinil)-2,2-dimetilciclopropanocarboxilato.
Empentrina, C18H26O2 , es el nombre común del
(E)-(RS)-1-etinil-2-metilpent-2-enil (1RS,3RS;1RS,3SR)-2,2-dimetil-3-(2-metilprop-1-enil)ciclopropanocarboxilato.
Las fórmulas estructurales de ambos compuestos se muestran en las Figuras 3 y
4.
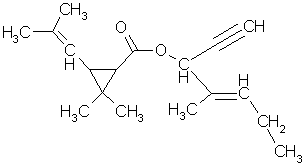
Figura 3. Fórmula estructural de la empentrina.
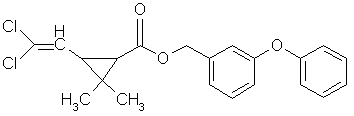
Figura 4. Fórmula estructural de la permetrina.
Otros antipolilla
alternativos, a veces anunciados como “sin productos químicos” son mezclas de
hierbas, aceite de cedro, hojas de laurel, e incluso ultrasonidos.
Otras cuestiones
de química que se pueden abordar en relación a lo tratado es solubilidad en
distintos disolventes, fabricación de los productos (el naftaleno, por ejemplo,
se obtiene destilando carbón y el alcanfor se obtiene por destilación de la
Madera del árbol que tiene el mismo nombre), uso e importancia de insecticidas,
etc. Quizá sea buena ocasión para recordar a los estudiantes que los homínidos
han estado en la tierra desde hace más de 3 millones de años, mientras que los
insectos han existido desde hace más de 250 millones de años.
Conclusión
final
En conclusión, el
uso de cuestiones sobre sustancias de uso común, bien conocidas por los
alumnos, como los antipolillas, puede ser una buena herramienta para motivarles
hacia el aprendizaje de conceptos de Química.
Bibliografía
- G. Pinto, “Chemistry
of moth repellents”, Journal of
Chemical Education, Vol. 82, 1321-1324 (2005).