FORMACIÓN “CASUAL” DE CLORURO AMÓNICO
EN EL LABORATORIO
Colocamos en
nuestro laboratorio, próximas entre sí, dos botellas (no herméticamente
cerradas) que contenían disoluciones de amoníaco y ácido clorhídrico. Al cabo de
unos días se observó la aparición de un sólido blanco sobre el tapón de la
segunda disolución. A partir de la fotografía obtenida, y que se muestra aquí,
se puede pedir a los alumnos que razonen una serie de consideraciones en
relación a: reacciones ácido-base, teoría cinético-molecular de los gases, ley
de Graham, entre otras cuestiones.

Figura 1. Fotografía de dos botellas de amoníaco y ácido clorhídrico en el laboratorio.
El tipo de sólido obtenido es el que justifica, en parte, la
película blanquecina que se forma a veces en las ventanas de los almacenes de
reactivo en el laboratorio.
Cuestiones:
Cuestión 1. Explicar la reacción que tuvo lugar en la Fig. 1 y escribir la
correspondiente ecuación balanceada.
Cuestión 2. Justificar por qué el sólido blanco se forma en torno al tapón de la
botella de HCl y no sobre el otro.
Cuestión 3. Calcular la velocidad cuadrática media (vrms)
de las moléculas de HCl y de NH3 a una
temperatura de 20ºC.
Soluciones:
Solución 1. Las moléculas de NH3 y de HCl en
fase gas se escapan parcialmente, primero de las correspondientes disoluciones,
y después por el hueco existente entre el tapón y la botella. La reacción de NH3
con HCl produce cristales blancos de cloruro amónico,
según la reacción:
HCl (g) + NH3 (g) ® NH4Cl (s)
Solución 2. La difusión es el proceso de mezcla que tiene lugar entre partículas de
un fluido por el movimiento térmico aleatorio, o el movimiento de moléculas de
una zona de mayor concentración a otra de menor. Las moléculas de amoníaco son
más ligeras y, por ello, se difunden más rápido que las de HCl
y, consecuentemente, las moléculas de NH3 y de HCl
colisionan más cerca de la botella del ácido. En otras palabras, el sólido se
forma más cerca de la fuente de HCl porque el gas
menos denso s (NH3) se difunde más rápido en el aire.
El proceso por el que un
gas se escapa a través de un orificio se denomina efusión. Dado que la masa de
las moléculas de NH3 es menor, tienen mayor velocidad a la misma
temperatura. La relación entre velocidades de efusión y masa molar, M, para dos
gases, se descubrió experimentalmente por Thomas Graham
(1805-1869), antes del desarrollo de la teoría cinético molecular de los gases.
En el caso que nos ocupa, la ley de Graham es:
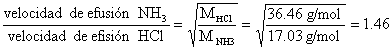
Se ha considerado que los tapones y huecos son análogos.
Solución 3. De acuerdo con la teoría cinético-molecular de los gases, la velocidad
cuadrática media (vrms) es la raíz
cuadrada de la media de los cuadrados de las velocidades de velocidades de
diferentes partículas y puede calcularse con la expresión:
![]()
Donde R es la
constante universal de los gases perfectos, T es la temperatura y M es la masa
molar. En nuestro caso, las velocidades, a 20 ºC,
son:
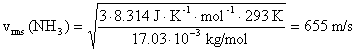
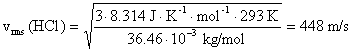
El cociente entre estos dos valores da 1.46, que es lo mismo que lo
obtenido por la ecuación de Graham. Cabe señalar que,
de acuerdo con la teoría cinético-molecular de los gases, la velocidad de
efusión de un gas es proporcional a su velocidad cuadrática media.
La velocidad vrms es una
propiedad cinética de valor parecido a la velocidad media de partículas a una
temperatura determinada, v, dado que vrms
= 0.921·v. A menudo los dos valores, v y vrms se consideran aproximadamente iguales.
Para visualizar la distinta velocidad de las moléculas de dos
gases, con distinto peso molecular, se ofrece el siguiente esquema:

Otras consideraciones:
Este ejemplo también puede servir para que los alumnos
perciban la importancia de almacenar correctamente los reactivos químicos. Por
ejemplo, para el ácido clorhídrico se sugiere almacenarlo en lugar fresco, seco
bien ventilado y alejado de bases.
Otras ideas que aporta esta experiencia son:
-
Se trata de una reacción ácido-base
para producir una sal. Implica transferencia de protones.
-
Las moléculas gaseosas de partida
son polares.
-
Los alumnos pueden dibujar los
diagramas de Lewis de las moléculas de NH3
y HCl, mostrando los pares de electrones solitarios y
compartidos. Pueden predecir también la geometría de las moléculas y colocar
las cargas parciales d+ y d-, como se muestra en la Fig.2.
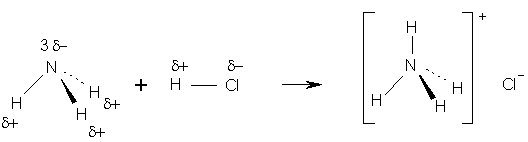
Figura 2. Representación esquemática de la reacción química. Se muestra además la geometría de las especies implicadas.
-
El sólido iónico está formado por
una red gigante de iones.
-
Los gases HCl
y NH3 son corrosivos y el NH4Cl(s)
(cristal iónico) muy poco. Muchos alumnos piensan que los cristales de NH4Cl formados en el tapón de la botella de HCl son peligrosos y el HCl(g) y el NH3(g)
no, porque no se ven.
-
Bibliografía:
1. G. Pinto, Education
in Chemistry, Vol. 40, pp. 80-81 (2003).
2. T.L. Brown, H.E. LeMay and
B.E. Bursten, Chemistry:
The Central Science, 7th Ed..
3. J. Morcillo, Temas Básicos de
Química, 2nd Ed. Madrid: Alhambra, 1977.
4. L.W. Fine, H. Beall and J. Stuehr, Chemistry for
Scientists and Engineers. Preliminary Ed..
5. T. Lister (compiler), Classic Chemistry Demonstrations, 1st Ed. London: Royal
Society of Chemistry, 1996.