USO DE CLOROISOCIANURATOS
PARA DESINFECCIÓN DEL AGUA
Aplicaciones de
cuestiones de Química para la comprensión de compuestos usados en la vida
cotidiana para la cloración del agua.
RESUMEN
Se
presentan una serie de ejercicios para estudiar cuestiones de Química, como
son: formulación, masa molecular, estequiometría, ecuaciones químicas, balanceo
de ecuaciones, números de oxidación, reacciones ácido-base, tautomería, cargas
formales, resonancia, agentes de cloración, y uso del cloro para la desinfección
del agua, entre otras. Todas estas cuestiones se pueden estudiar, al menos en
parte, mediante la información que se ofrece en los envases de
cloroisocianuratos, como el cloroisocianurato sódico (anhídrido o dihidratado)
o el ácido tricloroisocianúrico, que se utilizan para desinfectar el agua.
Estos productos se encuentran en casi todos los hipermercados. Con este trabajo
se pretende que los profesores dispongan de otra herramienta para mostrar a sus
alumnos el interés y versatilidad de las cuestiones de Química. Cada profesor
debería adecuar los ejercicios propuestos al nivel de sus alumnos.
INTRODUCCIÓN
Se
suele utilizar coloquialmente el término “cloro” como denominación genérica de
lo que, en realidad, son diferentes compuestos de cloro.
El
cloro es un desinfectante que se ha usado para el tratamiento de aguas desde
hace más de cien años. Su uso como desinfectante en agua potable y en piscinas
es bien conocido. El propósito fundamental de la desinfección del agua es
destruir organismos patógenos, con lo que se previenen enfermedades como
fiebres tifoideas, cólera, disentería y hepatitis.
El
cloro elemental se disuelve ligeramente en agua y se dismuta en ácido
hipocloroso (HClO) y ácido clorhídrico
(HCl):
![]() Cl2 + H2O D HClO
+ H+ + Cl- [1]
Cl2 + H2O D HClO
+ H+ + Cl- [1]
Donde
la constante de equilibrio a 25 ºC viene dada por:
![]() [2]
[2]
El
HClO es un ácido débil, que se disocia parcialmente:
HClO «
H+ + ClO- [3]
La
constante de disociación correspondiente, a 25 ºC, es:
![]() [4]
[4]
El
HClO es el principal desinfectante del agua. Se usa para matar bacterias y
algas, por lo que se comporta como un biocida, mientras que el ClO-
es un agente oxidante fuerte. Así, el cloro como tal no es un desinfectante,
sino en forma de HClO (para la sanitización) y de ClO- (para la
oxidación). En el equilibrio recogido en la ecuación 1se observa la formación
de HCl (ácido fuerte) en la hidrólisis de Cl2 disuelto, pero no es
dañino para el ser humano por su baja concentración.
El
pH del agua determina cuánto HClO, por la relación:
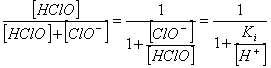 [5]
[5]
El
cloro es más eficiente para pH 7.4-7.6. De acuerdo con la ecuación anterior, a
altos valores de pH no se produce mucho desinfectante o HClO; dado que el cloro
está mayormente como hipoclorito. Por ejemplo, a pH 7.0, el 78% del cloro
existe como ácido hipocloroso, pero aumentando el pH hasta 8.0 se reduce la
concentración de ácido hipoclorosos hasta sólo un 26%.
El
ClO- se reduce al anión cloruro, que es inactivo, cuando cumple con
su tare oxidante, según la semi-rreacción:
ClO- + 2 H+ +
2 e- ®
Cl- + H2O [6]
Como
desinfectante del agua, el cloro se presenta de diversas maneras: cloro gas (se
distribuye como líquido a presión), cloroisocianuratos (dicloroisocianurato
sódico o ácido tricloroisocianúrico), hipoclorito cálcico, hipoclorito de
litio, e hipoclorito sódico. El Cloro libre disponible, conocido normalmente
por el acrónimo FAC (del ingles Free available chlorine) en el
tratamiento industrial de aguas, es una medida del poder oxidante o biocida del
cloro activo en un componente, expresado en términos de cloro elemental, y se
da normalmente en porcentaje en peso.
El
cloro disponible combinado es el cloro existente en el agua combinado con
amoníaco o compuestos orgánicos nitrogenados (como aminas y proteínas), que se
conocen como cloraminas. Las cloraminas no presentan propiedades desinfectantes
y causan problemas como irritaciones oculares o de la piel, así como olores
desagradables en piscinas. Las cloraminas también se conocen como cloro
residual combinado y deben suponer una cantidad
mínima.
En
la Tabla 1 se muestran las fórmulas de ciertos compuestos de cloro y el Cloro
libre disponible correspondiente. Estos datos se pueden encontrar en las
etiquetas de estos productos en los supermercados.
Tabla 1.
Fórmulas y Cloro libre disponible (FAC)
de cloroisocianuratos comunes.
Sustancia Fórmula
química FAC / % peso
Cloro Cl2 100
Dicloroisocianurato
sódico(NaDCC)
anhídrido C3Cl2N3O3Na 62-63
dihidratado C3Cl2N3O3Na·2H2O 55-56
ácido
tricloroisocianúrico (TCC) C3Cl3N3O3 89-91
La
luz ultravioleta degrada el cloro por una reacción fotoquímica:
2 Cl2 + 2 H2O U.V.® 4 HCl + O2 [7]
Si
no se utiliza el ácido isocianúrico (1,3,5-triazina-2,4,6 (1H,3H,5H)-triona)
como estabilizante, en un día soleado, el 90% del cloro activo se podría
destruir por la acción del sol, en dos horas.
El
dicloroisocianurato sódico (1,3-dicloro-1,3,5-triazina-2,4-diona-6-oxido
dicloro), conocido por las siglas NaDCC, es el único tipo de cloro que no
requiere la adición de neutralizante quimica o ácido isocianúrico, porque las
disoluciones de NaDCC tienen un pH próximo a 7 y ofrecen la adecuada relación
de cloro y estabilizante (ácido isocianúrico). Aparte de su uso en piscinas, el
NaDCC es ampliamente utilizado para desinfección de biberones y lentes de
contacto. El NaDCC es un oxidante que cuando se disuelve en agua se disocia en
HCLO (cloro libre) y ácdo isocianúrico (estabilizante). Se vende en forma de
granos y como tabletas (normalmente con base efervescente).
El
ácido tricloroisocianúrico (tricloro-1,3,5-triazinotriona), conocido como TCC,
se usa principalmente para agua de piscinas. Si no se usa adecuadamente puede
ser causa de corrosión y deterioro de la piscina. Es necesario añadir unos 350
g de Na2CO3 (sosa) por cada kg de TCC utilizado. No
requiere la adición de ácido isocianúrico.
A
continuación se sugieren cuestiones de Química sobre los compuestos citados en
esta introducción y sobre la cloración del agua.
CUESTIONES
Cuestión 1.
Buscando
en Internet, manuales de Química, libros de quimica Orgánica, o catálogos de
productos químicos, indicar la estructura quimica de los compuestos: NaDCC, TCC
y ácido isocianúrico.
Cuestión 2.
Según
se indica en la Introducción, cuando se disuelve en agua el NaDCC, se
descompone en ácido hipocloroso y ácido isocianúrico. Escribir la ecuación
química correspondiente balanceada.
Cuestión 3.
Si
la reacción de la cuestión anterior es del tipo redox, calcular el número de
oxidación de cada átomo y señalar las especies oxidantes y reductoras.
Cuestión 4.
Repetir
las cuestiones 2 y 3 para el TCC.
Cuestión 5.
Explicar cuáles de las especies
anteriores presentan resonancia o la posibilidad de tautomería.
Cuestión 6.
Explicar por qué la disolución de
NaDCC es neutra y la de TCC es ácida.
Cuestión 7.
Deducir por estequiometría los
valores de cloro libre disponible (FAC) mostrados en la Tabla 1.
RESPUESTA A LAS
CUESTIONES
Respuesta 1.
La estructura química de los
compuestos es:
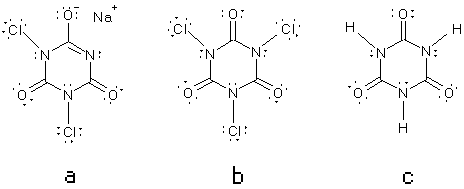
Figura 1.
Estructuras químicas del
dicloroisocianurato sódico (a), ácido tricloroisocianúrico (b), y ácido
isocianúrico(c).
Respuesta 2.
C3Cl2N3O3Na
(s) + 2 H2O (l) ® C3H3N3O3
(aq) + Na+ (aq) + ClO- (aq) + HClO (aq) [8]
Respuesta 3.
Para
calcular los números de oxidación, se procede:
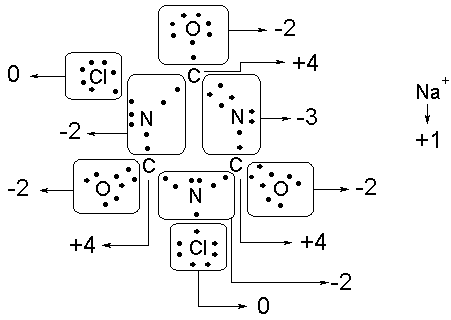
Figura 2.
Ejemplo de asignación de números de
oxidación para el NaDCC.
Siguiendo
el mismo procedimiento para la molécula de ácido isocianúrico, se concluye que
en la reacción 8, dos átomos de N se reducen de -2 a -3, y dos átomos de Cl se
oxidan de 0 a +1 (en la forma de HClO o ClO-). Así,dos átomos de N
son agentes oxidantes y dos átomos de Cl son reductores.
Respuesta 4.
C3Cl3N3O3
(s) + 3 H2O (l) ® C3H3N3O3
(aq) + 3 HClO (aq) [9]
Los tres átomos de N se reducen de
-2 a -3, actuando como oxidantes, y los tres átomos de Cl son reductores,
porque se oxidan de 0 a +1.
Respuesta 5.
En
el ácido isocianúrico y en el TCC, la resonancia no tiene importancia porque
otras formas resonantes a las expuestas en la figura 1 tienen más cargas
formales y por lo tanto contribuyen poco al híbrido de resonancia. Sin embargo,
el anión dicloroisocianurato del NaDCC tiene resonancia:
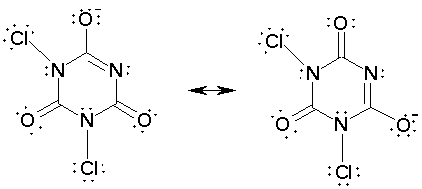
Figura 3.
Estructuras resonantes del anion
dicloroisocianurato.
Esta cuestión puede servir para
aclarar la diferencia entre carga formal y número de oxidación (considerado en
la cuestión 3). La carga formal es la calculada para cada átomo asumiendo que
los electrones compartidos se distribuyen equitativamente entre los dos átomos
enlazados, mientras que el número de oxidación asigna cada par de electrones
compartido al átomo más electronegativo.
Las dos estructuras de la Figura 3
tienen la misma contribución al híbrido de resonancia. Otras posibles presentan
más cargas formales, por lo que contribuyen menos al híbrido de resonancia. El
ácido isocianúrico tiene tautomería con el ácido cianúrico:
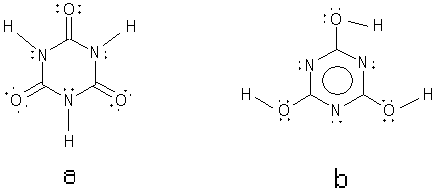
Figura 4.
Tautomería del ácido isocianúrico (a) y
el ácido cianúrico (b).
Respuesta 6.
Como
se demuestra en la ecuación 8, la disolución de NaDCC genera un ácido débil y
una disolución amortiguadora de HClO y ClO-, pero la reacción 9
genera dos ácidos.
Respuesta 7.
Los
pesos moleculares son: NaDCC anhídrido (220.0 g/mol), NaDCC dihidrata (256.0 g/mol), TCC (232.5 g/mol) y ácido
isocianúrico (129.1 g/mol). Tomando como ejemplo la reacción de disolución del
NaDCC anhídrido descrita en la ecuación 8, y la equivalencia entre cloro ácido
hipocloroso o hipoclorito de la ecuación 1, el FAC de 100 g de NaDCC anhídrido
es:
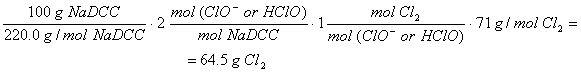 [10]
[10]
Como se observa en la Tabla 1, el
valor tabulado es 62-63 %, i.e.,
ligeramente inferior al calculado. Procediendo de forma análoga, se llega a que
el FAC de 100 g de NaDCC dihidrato es 55.5 g y para 100 g de TCC el valor es
91.6. En ambos casos estos valores son próximos a los de la tabla. Para el cloro, el FAC es 1000 % por definición.
BIBLIOGRAFÍA:
G. Pinto, B. Rohrig, “Use of
chloroisocyanurates for disinfection of water”, Journal of
Chemical Education, Vol. 80, pp. 41-44, 2003.