 ESTEQUIOMETRÍA
EN MEDICAMENTOS CON CALCIO
ESTEQUIOMETRÍA
EN MEDICAMENTOS CON CALCIO
Con los ejercicios que se proponen
en este trabajo se abordan esencialmente cuestiones de estequiometría, pero
también se pretende que los alumnos utilicen conceptos como: formulación, sales
orgánicas, hidratación de sales, funciones fisiológicas de los elementos,
principios activos y excipientes de medicamentos, isomería, resonancia,
búsqueda de datos (Internet, manuales, etc.), entre otros.
Una de las fuentes de información
que se pueden utilizar para desarrollar actividades del tipo de las que aquí se
proponen, es el Vademécum de especialidades farmacéuticas, muy utilizado por
los profesionales sanitarios para identificar, prescribir y dispensar
medicamentos. Los alumnos, en general, pueden tener cierta familiaridad con él
porque es fácil observarlo en las consultas médicas. Los ejemplos que se
proponen tendrían que adecuarse, en cada caso, al nivel de los alumnos.
El calcio es el quinto elemento más abundante en el
cuerpo humano. Aunque la mayor parte es constituyente de la masa ósea, también
juega importantes funciones fisiológicas. Se ofrecen, como ejemplos, varias
cuestiones de conceptos de Química referidas a medicamentos que contienen ese
elemento.
Cuestión 1. En los prospectos
de varios medicamentos se informa que una cantidad de diversos compuestos (por
comprimido, sobre o cucharada) equivale a cierta cantidad de calcio, según se
indica entre paréntesis:
- Medicamento A: 1250 mg
carbonato cálcico (500 mg Ca).
- Medicamento B: 1260 mg carbonato
cálcico (500 mg Ca).
-
Medicamento C: 1500 mg carbonato cálcico (600 mg Ca).
-
Medicamento D: 2500 mg carbonato cálcico (1000 mg ó 25 mmol Ca).
-
Medicamento E: 3,30 mg fosfato cálcico (1,2 g Ca).
-
Medicamento F: 1 cucharada (=15 mL) de disolución en la que por 100 mL hay 1671
mg de fosfato cálcico (100 mg Ca).
-
Medicamento G: 1 cucharada (=15 mL) de disolución en la que por 100 mL hay 2088
mg de fosfato cálcico (125 mg Ca).
-
Medicamento H: 1 cucharada (=15 mL) de disolución en la que por 100 mL hay 3088
mg de fosfato cálcico (180 mg Ca).
- Medicamento I: 3750 mg
pidolato cálcico (500 mg Ca).
Verificar las citadas equivalencias.
Solución a la cuestión 1. Para resolver esta cuestión es necesario formular
los diversos compuestos, calcular los pesos moleculares correspondientes y
establecer los cálculos estequimétricos adecuados. En cuanto a formulación, la
más compleja para los alumnos es la correspondiente al medicamento I, porque
deben conocer que el anión pidolato es:
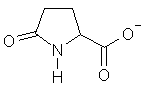
Así, el peso molecular del pidolato cálcico, Ca(C5H6O3N)2
es 296,3 g/mol
En el medicamento A, que se toma como ejemplo, el
cálculo estequiométrico implica plantear la expresión:
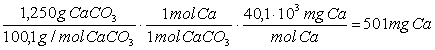
Los valores de equivalencia en Ca obtenidos para el resto
de los medicamentos por razonamientos análogos son: B (505 mg), C (601 mg), D
(1001 mg ó 25 mmol), E (1,28 g), F (97 mg), G (122 mg), H (180 mg) e I (508
mg). Como cabía esperar, son próximos a los indicados por el fabricante, si
bien en algunos casos hay variaciones significativas, que oscilan entre –3% y
+7%.
Cuestión 2. En la información sobre un medicamento se indica
que contiene 800 mg de fosfato cálcico, 200 mg de carbonato cálcico y 5 mg de
fluoruro cálcico por comprimido. También se indica que esas cantidades
equivalen a 393 mg de calcio elemento y 2,43 mg de flúor elemento. Se pide
verificar esas equivalencias.
Solución a la cuestión 2. Los
cálculos estequiométricos, en este caso algo más complejos que en la cuestión
anterior por estar referidos a varios compuestos, llevan a que, como se indica,
esas sales equivalen a 393 mg de calcio; sin embargo, se obtiene que el CaF2
equivale a 2,57 g de flúor elemento (lo que supone cerca de un 6 % más de lo
señalado).
Cuestión 3. Según el prospecto de un medicamento, recomendado
para estados carenciales de vitaminas y sales minerales, cada comprimido
contiene, entre otras sustancias, 90 mg de calcio como fosfato cálcico y 70 mg
de fósforo, también como fosfato cálcico. A partir de estos datos, comprobar que
el “fosfato cálcico” que se indica no responde a la fórmula Ca3(PO4)2.
A veces, en farmacología, se emplea el término “fosfato tricálcico” para esta
fórmula, mientras que se reserva el término “fosfato cálcico” a una sal ácida
de fosfato. Si fuera así, determinar de qué sal se trataría.
Solución a la cuestión 3. Con
los datos aportados, la relación, en moles, de Ca:P resulta ser 1:1, con lo que
no se trata del Ca3(PO4)2
sino de la sal Ca(HPO4).
Cuestión 4. La composición
de cada comprimido efervescente de un medicamento, indicado para el tratamiento
de estados que cursan con descalcificación, en especial la osteoporosis,
muestra que, entre otros componentes, contiene 2,94 g de lactatogluconato de
calcio y 0,30 g de carbonato cálcico, que equivalen a 380 mg de calcio
elemento. Se pide verificar esta equivalencia.
Solución a la cuestión 4. El
lactatogluconato de calcio presenta una estequiometría de tres moles de lactato
cálcico por cada dos moles de gluconato cálcico monohidrato. La fórmula
molecular del lactato cálcico es Ca (CH3-CHOH-COO)2 y la
del gluconato cálcico monohidrato es Ca(HOCH2-(CHOH)4-COO)2
· H2O, por lo que la fórmula del lactatogluconato cálcico es C42H74O46Ca5
· 2 H2O (teniendo un peso molecular de 1551,49 g/mol) . Con lo
que 2,94 de este compuesto equivalen a:
![]()
Teniendo en cuenta que 0,30 g de CaCO3 equivalen a 120 mg
de Ca, se obtiene que la equivalencia en calcio total, por cada comprimido
efervescente es, como indica el fabricante, 500 mg.
Cuestión 5. Como ejemplo de
otros tipos de cuestiones que se pueden sugerir a los alumnos, aparte de
cálculos estequiométricos, se solicita que determinen el número de
estereoisómeros que pueden tener el anión lactato y el anión gluconato, citados
en la cuestión anterior.
Solución a la cuestión 5. El
anión lactato presenta un carbono asimétrico, y presenta por lo tanto dos
configuraciones (arreglo de átomos que caracterizan a un estereoisómero
determinado). El anión gluconato posee cuatro centros quirales porque tiene
cuatro carbonos asimétricos; el número máximo de estereoisómeros que pueden
existir es igual a 2n, donde n es el número de centros quirales. En
este caso, por no haber compuestos meso, se tiene ese número máximo de
estereoisómeros, es decir 16.
Además de las ideas sugeridas, con los compuestos estudiados se puede
pedir a los alumnos que discutan sobre la resonancia de los aniones fosfato y
carbonato, citados en algunos ejercicios, y otras muchas cuestiones.
Bibliografía:
G. Pinto, “Stoichiometry of calcium
medicines”, Journal of Chemical Education, Vol. 82, 1509-1512
(2005).