SOLUCIÓN AL PROBLEMA 2.1
Para realizar los cálculos, es necesario conocer el volumen de la bombilla, que se considera una esfera. Se obtiene así V= 0,113 L, para aplicar en p*V = n*R*T.
Para conocer el número de átomos en fase gas a cada temperatura, se aplicará la ecuación de Clausius Clapeyron que relaciona las presiones de vapor de un sólido a dos temperaturas:
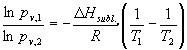
Con los dos datos de presiones de vapor que aporta el problema, se obtienen DHsubl.=186 kcal/mol, y con este valor, se pueden obtener ya los resultados:
A
25ºC (298K) ---> pv = e-297 atm ---> n= 0 moles
---> 0 átomos W en fase gas
A 3000ºC (3273K) ---> pv = 1,2*10-6 atm ---> n= 5,0*10-10 moles ---> 3,0*1014 átomos W en fase gas
Comentario: en ambos casos el número de átomos en fase gas es muy pequeño (aunque 3,0*1014 puedan parecer muchos átomos, representan sólo 9*10-8 g de W), dado que es un sólido muy poco volátil. Es especialmente llamativo que haya 0 átomos en fase gas a 25ºC, pero se debe tener en cuenta:
1.- La presión de vapor (equilibrio W(sólido) « W (vapor) es muy pequeña (e-297 atm).
2.- Se ha utilizado un valor de variación de entalpía de sublimación, calculado entre 3000 y 3500 K, para obtener la presión de vapor a 298 K, con lo que se supone constante esa variación de entalpía en un intervalo muy amplio de temperaturas.