SOLUCIÓN AL PROBLEMA 1.3
Sean : G(kmol/h) de gas materia prima, P (kmol/h) de gas de purga y R (kmol/h) de gas de reciclo.
La reacción que tiene lugar es :
S + H2 ® SH2
El esquema del proceso es :
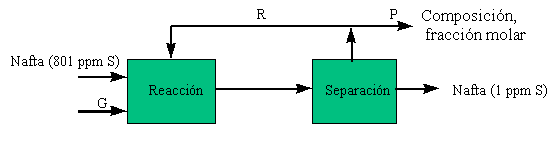
1.- Por balance de azufre en kmol/h :
![]()
Con XSH2 = 0,01 (máximo admisible), resulta.
P = 25 kmol/h
2.-
Por balance de hidrógeno en kmol/h :
![]()
Por balance de inertes en kmol/h :
G * 0,25 = P * XI
Por suma de fracciones molares :
0,01 + XI + XH2 = 1
Resolviendo se obtiene :
G = 25 kmol/h
; XI = 0,25 ; XH2 = 0,74
3.- La proporción de los dos gases inertes se mantendrá igual a la de entrada de gas :

De este modo queda definida la composición de los gases de reciclo :
La relación molar nafta/hidrógeno será :
![]()
Siendo 100 kg/kmol , el peso molecular del C7H16.
Despejando
R se obtiene : R = 515,2 kmol/h