SOLUCIONES AL TEMA 7
7.1
a) 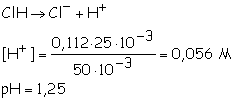
b) 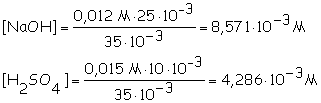
Se produce la
neutralización completa de un ácido poliprótico.
1ª etapa
NaOH + H2SO4
® Na+ + H2O + HSO4-
OH- + H+ « H2O
|
Especies |
NaOH |
H2SO4
|
Na+ |
HSO4- |
|
Concentración inicial |
8.571*10-3 |
4.286*10-3 |
0 |
0 |
|
Concentración que reacciona |
4.286*10-3 |
4.286*10-3 |
|
|
|
Concentración en el equilibrio
|
4.286*10-3 |
0 |
4.286*10-3 |
4.286*10-3 |
2ª etapa
NaOH + HSO4- ® Na+ + H2O
+ SO42-
|
Especies |
NaOH |
HSO4- |
Na+ |
SO42- |
|
Concentración inicial |
4.286*10-3 |
4.286*10-3 |
4.286*10-3 |
0 |
|
Cantidad reaccionante |
4.286*10-3 |
4.286*10-3 |
|
|
|
Concentración en el equilibrio
|
0 |
0 |
8.571*10-3 |
4.286*10-3 |
Cálculo del pH : suponiendo
que no hay hidrólisis, el pH sería 7. Si hay hidrólisis, el pH será mayor que
7. (Ver problema 7.4)
c)
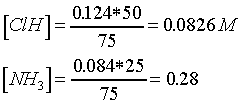
HCl + NH4OH ® ClNH4 + H2O
|
Especies |
HCl |
NH4OH
|
ClNH4
|
|
Concentración inicial |
0.0826 |
0.028 |
0 |
|
Cantidad reaccionante |
0.028 |
0.028 |
0 |
|
Concentración en el equilibrio
|
0.0546 |
0 |
0.028 |
Se trata de una mezcla
de ácidos
[H+] = [HCl] =
0,0546 M ; pH = 1,26
![]()
7.2
Acido CO2 + H2O « HCO3-
+ H+
Base BaO + H2O « Ba(OH)2
Acido de Lewis AlCl3
Acido Al3+ + 3 H2O « Al(OH)3 + 3 H+
Acido H+
![]()
7.3
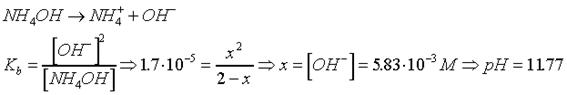
Después de la primera
adición de HCl :
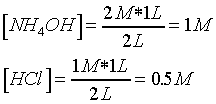
Se produce una
neutralización incompleta
NH4OH + HCl ® NH4Cl + H2O
|
Especies |
HCl |
NH4OH
|
ClNH4
|
|
Concentración inicial |
0.5 |
1 |
0 |
|
Cantidad reaccionante |
0.5 |
0.5 |
|
|
Concentración en el equilibrio
|
0 |
0.5 |
0.5 |
Se trata de un tampón
básico.
Para el cálculo del
pH : Fórmula tampón básico o tratamiento como efecto ion común
|
Especies
|
NH4OH
|
NH4+
|
OH- |
|
Concentración inicial |
0.5 |
0.5 |
0 |
|
Cantidad reaccionante |
x |
x |
|
|
Concentración en el equilibrio
|
0.5 - x |
0.5 + x |
x |
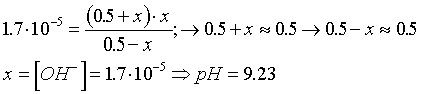
Después de la segunda
adición de HCl
Nuevas concentraciones :
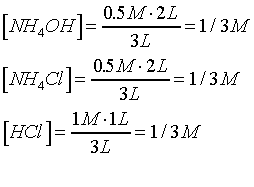
Neutralización
completa:
NH4OH + HCl ® NH4Cl + H2O
|
Especies
|
HCl |
NH4OH
|
ClNH4
|
|
Concentración inicial |
1/3 |
1/3 |
1/3 |
|
Cantidad reaccionante |
1/3 |
1/3 |
|
|
Concentración en el equilibrio
|
0 |
0 |
2/3 |
Cálculo del pH :
pH resultante de la Hidrólisis de la sal cloruro amónico
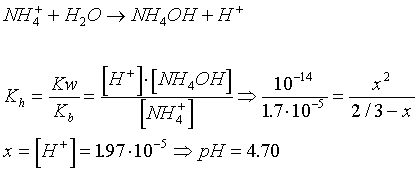
Después de la tercera adición
de HCl
Nuevas
concentraciones :
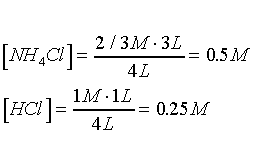
En este caso tenemos
una mezcla de ácidos .
Situación final :
pH resultante del ácido fuerte :
HCl ® H+
+ CL-
|
Especies |
HCl |
H+ |
Cl- |
|
Concentración inicial |
0.25 |
0 |
0 |
|
Cantidad reaccionante |
0.25 |
|
|
|
Concentración en el equilibrio
|
0 |
0.25 |
0.25 |
pH = - log 0,25 = 0,60
![]()
7.4
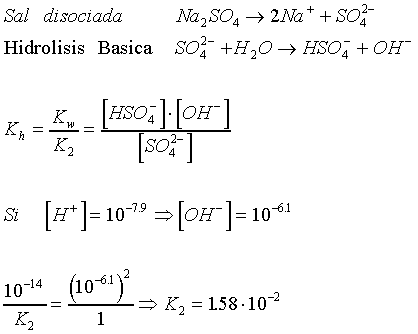
![]()
7.5
Disociación 99,6 %
![]()
7.6
DH0 = 49.4 KJ/mol
![]()
7.7
Se producen tres equilibrios simultáneos
HCl ® H++Cl-
|
HCl |
H+ |
Cl- |
|
|
x + y + z |
x |
HF « H++F-
|
HF |
H+ |
F- |
|
|
x + y + z |
y |
H2O « H++OH-
|
H2O |
H+ |
OH- |
|
|
x + y + z |
z |
.[H+]TOTALES = [H+]HCl
+ [H+]HF + [H+] H2O

![]()
7.8
pH = 4,74
nº equivalentes-gramo = 0,16
![]()
7.9
pH = 10,26
![]()
7.10
moles ( HNa2PO4 ) = 1,26
Variación de pH = 0,027
![]()
7.11
Kb = 4,4*10-4
pH inicial = 11,94
pH ( 10 ml ) = 10,50
pH ( 20 ml ) = 1,69
Rojo de metilo o Rojo de clorofenol
![]()
7.12
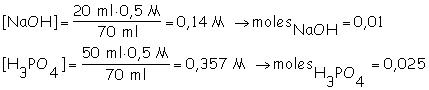
Neutralización incompleta:
NaOH + H3PO4 ® NaH2PO4
+ H2O
|
Especies |
NaOH |
H3PO4 |
Na H2PO4
|
|
Moles inicial |
0.01 |
0.025 |
0 |
|
Moles reaccionantes |
0.01 |
0.01 |
|
|
Moles en el equilibrio |
0 |
0.015 |
0.01 |
Solución amortiguadora
ácida (K1= 7.1*10-3)
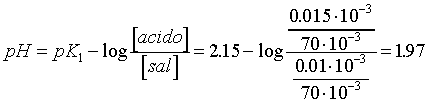
[H+] = 0,010 M
[OH-] = 10-12
M
[H3PO4]
= 0,214 M
[H2PO4-]
= 0,143 M
[HPO42-] = 8,9 * 10-7 M
[PO43-] = 4,4 * 10-17 M
[Na+] = 0,143 M
[H2O] = 55,55 M
![]()