SOLUCIONES AL TEMA 4
4.1 a) Orden respecto
de A = 1. Orden respecto de B = 0
b) Constante de velocidad: k = 0,2 s-1
c) Ley diferencial de velocidad: v = k [A]
![]()
4.2.a) Se trata de una cinética de orden 1; v = k [N2O5]
Ln (C/Co) = - kt ; Co = (2,5 moles/5litros) = 0,5 M
Ln (C/Co) = - 1,68*10-2*60
La [N2O5]
que queda después de un minuto será:
C = 0,182 M
y los moles son : N2O5
= 0,182*5 = 0,9 moles.
b) Moles tras
reaccionar:
![]()
|
2,5 - x |
x |
1/2 x |
2,5 - x = 0,9
x = 1,6
Moles de O2 = 0,8
c) t1/2 =
(Ln 2)/k = 0,693/(1,68*10-2) = 41,25 s
d) La velocidad de
reacción sólo depende de la concentración de N2O5
v = k [N2O5]
Si [N2O5] = 2*0,5 = 1 M
vinicial =
1,68*10-2*1 = 1,68*10-2 M ·s-1
![]()
4.3.a) Orden 1 no puede ser porque el valor t1/2
según los datos varía con la [HI] inicial, y para el orden cinético 1, t1/2
es independiente de la concentración inicial.
Probamos orden 2: t1/2
= 1/(Co*k), para dos valores distintos de [HI]inicial se cumple la
ecuación:
t1/2 = 1/(0,1 k427)
= 59,0 min
k427 = 0,17 M-1
min-1
t1/2 = 1/(0,080 k427) = 73,0 min
Luego el orden cinético
de la reacción es 2
b)
k427 = 0,17 M-1
min-1
k508 = 2,38 M-1
min-1
c)
Ln (k1/k2) = (-EA/R)*(1/T1 - 1/T2)
Ln (0,17/2,38) = (-EA/2)*(1/(427+273) - 1/(508+273))
EA = 35663 Cal/mol
d) Aplicando la
ecuación de Arrhenius podemos conocer el valor del factor de frecuencia
"A":
k427 = A*exp(-EA/RT)
; 0,17 = A*exp[-35663/(2(427+273))]
A = 1,96*1010 M-1
min-1
e) Necesitamos calcular el valor de k a 450º C:
k450 = A*exp(-EA/RT)
= 1,96*1010*exp[-35663/(2(450+273))]
k450 = 0,38 M-1
min-1
El tiempo necesario
para la descomposición del 50 % de la concentración inicial (Co=0,050 M) será:
t1/2 = 1/(Co*k450) = 1/(0,050*0,38) = 52,63
min
El tiempo necesario
para la descomposición del 80 % de la concentración inicial (Co=0,050 M) será:
C = 0,050 - 0,8*0,050 =
0,01
1/C -1/Co = k450*t
; 1/0,01 - 1/0,050 = 0,38t
t = 210 min
![]()
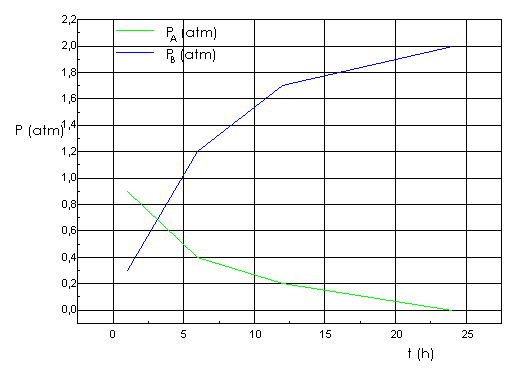
4.4. Como A se descompone según la
ecuación v = - dPA/dt = kPA, la cinética es orden 1,
luego:
Ln PA - Ln PoA = - kt ó bien PA =
PoA*exp(-kt) (1)
Según la estequiometría
de la reacción:
A(g) ® 2 B(g)
|
inicialmente |
PoA |
0 |
|
finalmente |
PA = PoA - PB/2 |
PB |
PA = PoA - PB/2
PB = 2 (PoA - PA)
Sustituyendo PA por (1)
(2) PB = 2 PoA (1- exp(-kt))
La ecuación (1) nos
indica como varía en función del tiempo la presión de A (PA) y la
ecuación (2) nos indica como varía en función del tiempo la presión de B (PB).
La representación
gráfica de valores de PA y PB (Tabla 1), calculados
mediante las ecuaciones (1) y (2), frente a distintos tiempos a lo largo de un
día nos lleva al diagrama correspondiente (fig. 1).
Tabla1. Valores de PA y PB
para distintos tiempos.
|
t (h) |
1,0 |
6,0 |
12,0 |
24,0 |
|
PA (atm) |
0,86 |
0,41 |
0,17 |
0,03 |
|
PB (atm) |
0,28 |
1,19 |
1,67 |
1,95 |
![]()
4.5. EA
(catalizador) = 37,2 kJ/mol
![]()
4.6. Reacción total: 4B ® 3C + F
A = catalizador
B = reactivo
D y E = intermedios de
reacción
C y F = productos
![]()
4.7. Ley de velocidad v = k [NO]2 [O2]
Están de acuerdo los mecanismos
B y C, dado que conducen ambos a la siguiente expresión:
v = k2k1/(k-1) [NO]2 [O2]
Hay otros muchos
mecanismos que pueden explicar esta cinética. Por ejemplo, la reacción directa
termolecular.
![]()