SOLUCIONES AL TEMA 1
1.1- U0 = -2444 kJ / mol
![]()
1.2- U0 = -2578 kJ / mol .
Algo mayor porque hay
participación de otras interacciones además de enlace iónico (única considerada
en el ejercicio 1.1 )
![]()
1.3- U0 = -622 kJ / mol ;
H0f
= 655 kJ / mol . PROCESO ENDOTÉRMICO
![]()
1.4- -193 kJ / mol
![]()
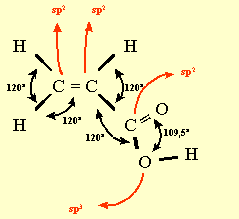
1.5-
a) Geometría (por RPENV
o hibridación).
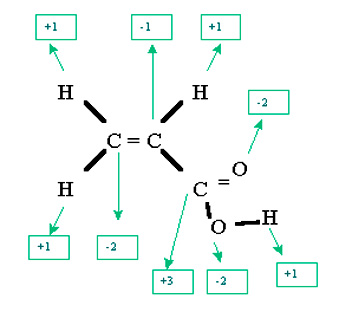
Cargas formales :
todos los átomos 0. Números de oxidación :
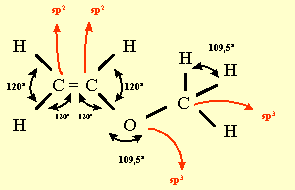
Geometría (por RPENV o
hibridación).
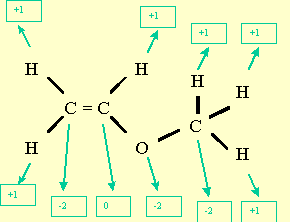
Cargas formales :
todos los átomos 0. Números de oxidación :
![]()
1.6-
NCl3 :
Piramidal
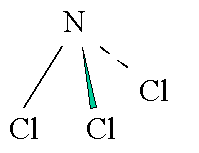
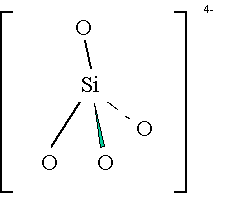
SiO44- :
Tetraédrica
CS2 : Lineal
S=C=S
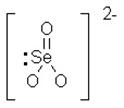
SeO32- : Piramidal
ClF3 :
Forma de T
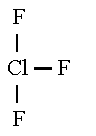
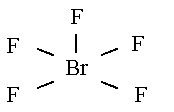
BrF5 :
Piramidal Cuadrangular
ICl4- :
Plano Cuadrada
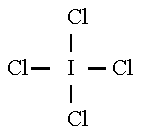
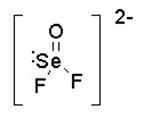
F2SeO :
Piramidal
![]()
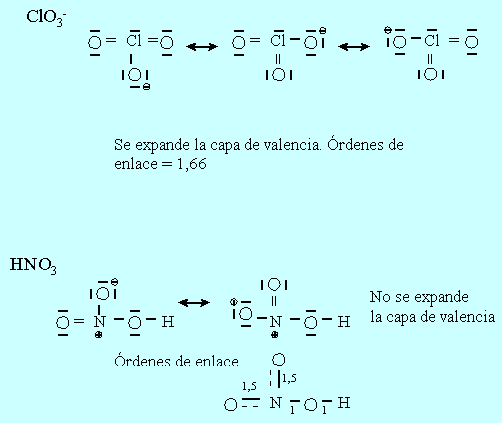
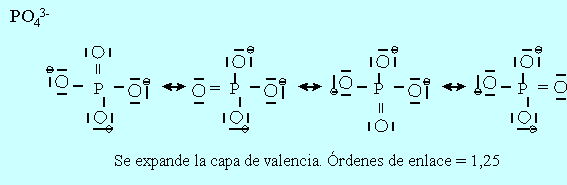
1.7-
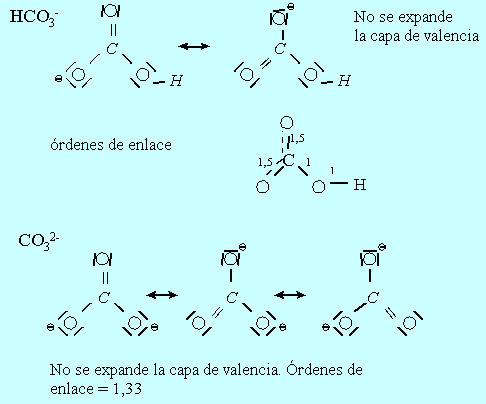
![]()
1.8-
- CO : 3 ( Se deduce de la Teoría de
Orbitales Moleculares )
- SH2 : 1
- IO65- : 7/6
![]()
1.9-
|
Especie |
O22- |
O2- |
O2 |
O2+ |
O22+ |
|
Orden del enlace |
1 |
1.5 |
2 |
2.5 |
3 |
|
Carácter Magnético |
Diamagnético |
Paramagnético |
Paramagnético |
Paramagnético |
Diamagnético |
Distancias de enlace O-O : O22- > O2-
> O2 > O2+ > O22+
![]()
1.10-
|
Configuración electrónica del átomo |
Orden de enlace de la molécula |
|
Na : [Neón] 3s1
|
Na2 : 1.0
|
|
Neón : [He] 2s2
2p6 3s2 |
Ne2 : 0.0
|
|
Au : [Xe] 4f14
5d10 6s1 |
Au2 : 1.0
|
|
Hg : [Xe] 4f14
5d10 6s2 |
Hg2 : 0.0 |
![]()
1.11 - NO+
![]()