SOLUCIONES A LOS PROBLEMAS DE QUÍMICA
ORGÁNICA
12.1
a)
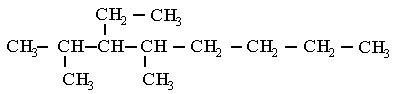
b)
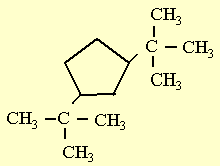
c)
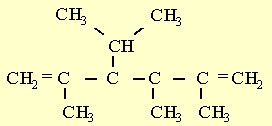
d)

e)
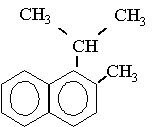
f)

g)
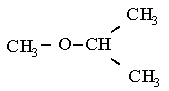
h)
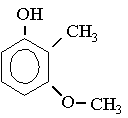
i)
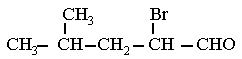
j)
![]()
k)

l)
![]()
m)
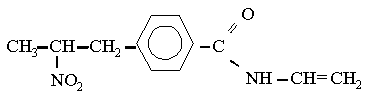
![]()
12.2 a) 3,4-dimetil-4-etilheptano (o
4-etil-3,4-dimetilheptano).
b) 1-metil-2-isopropilciclopropano
(o 1-isopropil-2-metilciclopropano).
c).
1-cloro-2-etilciclobutano.
d) 5-metil-2-hexeno.
e) 3-metilciclohexeno.
f) 3,6-dimetil-1,3,5-heptatrieno.
g) bifenilo o
fenilbenceno.
h)
1-metil-3-etilnaftaleno. (o 3-etil-1-metilnaftaleno)
i)
2-(4-N,N-dimetilciclohexilamina)-1,3-propanodiamina.
j)
2-metil-5-hidroxibenzaldehido.
k) Ácido
ciclohexanocarboxílico.
l) Anhídrido ftálico.
m) 5-hepten-3-ona.
n)
2-metil-4-fenil-3-hexanol (o 4-fenil-2-metil-3-hexanol).
ñ) Dodecanato sódico.
![]()
12.3
|
a) |
CHBr2 - CH2 - CH3
|
1,1-dibromopropano |
|
b) |
CH3
- CBr2 - CH3 |
2,2-dibromopropano |
|
c) |
CH2Br
- CHBr - CH3 |
1,2-dibromopropano
(tiene
dos enantiómeros: dextrogiro y levogiro) |
|
d) |
CH2Br - CH2 - CH2Br
|
1,3-dibromopropano |
![]()
12.4
a) No tiene isómeros.
b)

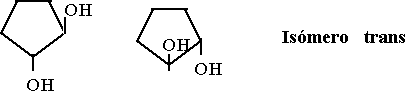
Ambas estructuras son
los dos enantiómeros del isómero trans. Son ópticamente activos.
c)

Son enantiómeros. Son
ópticamente activos.
![]()
12.5 a) Punto de ebullición
n-propílico > punto de ebullición del metoxietano. Mayor interacción entre
las moléculas del alcohol por formación de puentes de hidrógeno.
b) Punto de ebullición
del isómero cis > punto de ebullición del isómero trans, por tener el
isómero cis momento dipolar distinto de cero y el isómero trans momento dipolar
igual a cero.
c) Punto de ebullición
del ácido acético > punto de ebullición del formiato de etilo. La
interacción entre las moléculas de ácido acético es mayor por formación de
puentes de hidrógeno.
d) Punto de ebullición
de la metiletilamina > punto de ebullición de la trimetilamina. La
interacción entre las moléculas de metiletilamina es mayor por formación de
puentes de hidrógeno.
e) Punto de ebullición
del pentano > punto de ebullición del dimetilpropano. Mayores fuerzas de
interacción entre las moléculas de pentano. (menos ramificado, se asemeja menos
a una esfera que el dimetilpropano, su superficie es mayor y también las
fuerzas de interacción).
![]()
12.6 ciclohexano < ciclohexanol
< fenol < o-nitrofenol.
![]()
12.7
a)
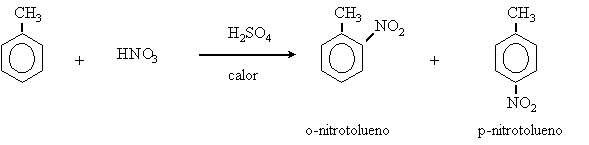
b)
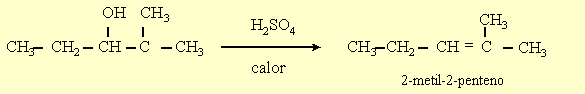
c)
![]()
d)
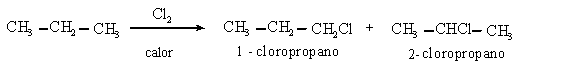
e)
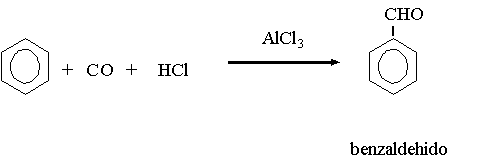
f)

![]()
12.8
a)
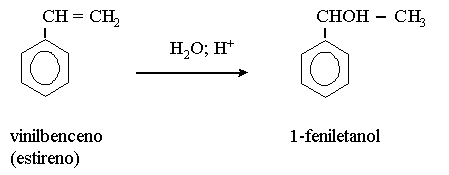
b)
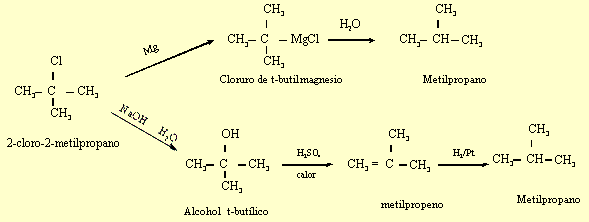
c)

d)
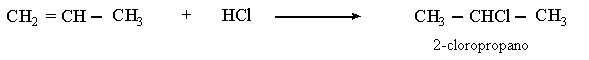
e)
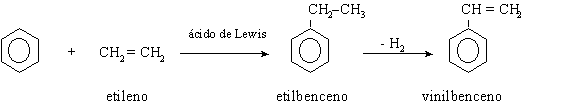
f)
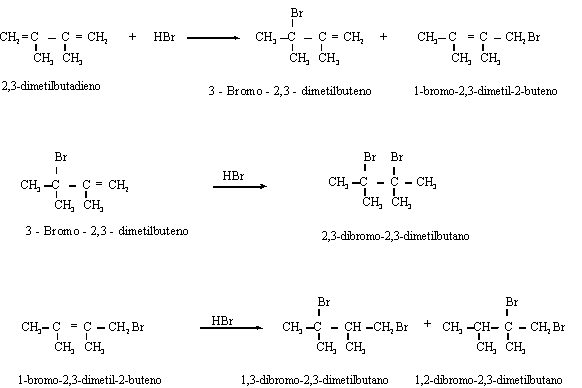
g)
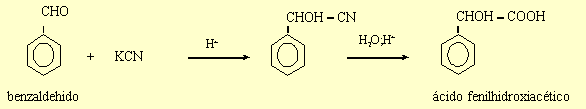
h)
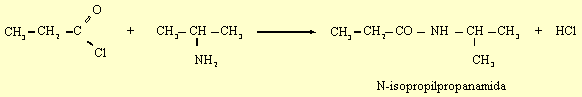
i)
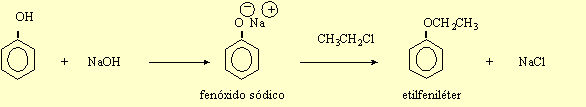
j)

k)

l)
![]()
m)
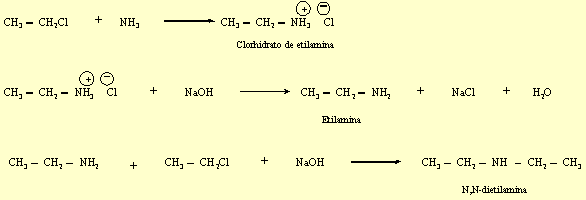
![]()
12.9
a)
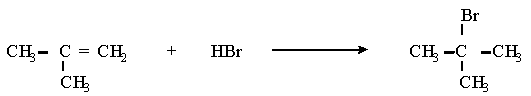
Es una adición
electrófila.
b)

Es una sustitución
aromática electrófila.
c)
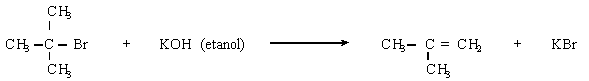
Es una reacción de eliminación
unimolecular
d)
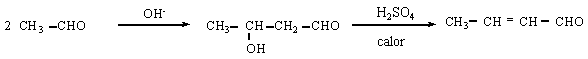
Es una condensación
aldólica y posteriormente la deshidratación de un alcohol.
e)
![]()
Es una sustitución
nucleófila bimolecular.
![]()
12.10
A) Eteno.
B) Yoduro de etilo.
C) Etilamina.
D) Cloruro de etilo.
E) Cloruro de etilmagnesio.
F) 1-Propanol.
G) Ácido propanoico.
H) Cloruro de
propanoílo.
I) N-etilpropanamida.
J) Clorhidrato de
etilamina (o cloruro de etilamonio).
![]()
12.11

![]()