LA RESOLUCIÓN DE PROBLEMAS DE BALANCE DE MATERIAS
Introducción. Con mucha
simplificación y parcialidad se puede decir que un ingeniero es un resolvedor de
problemas. Por ello resulta esencial en la formación de ingenieros intensificar
y potenciar el hábito en la resolución de problemas. Los estudiantes aprenden a
resolver problemas mediante la aplicación de leyes físicas y químicas, usando
métodos y técnicas sencillas y un poco de sentido común.
La práctica y
perseverancia en la realización de muchos problemas desarrolla la destreza y
experiencia necesarias para atacar y resolver otros con éxito.
Los problemas de
balance de materias dentro de la Ingeniería Química no nuclear son aquellos en
los que se pide determinar la masa de sustancias químicas que se mezclan, se
separan en varias fases o corrientes, o se combinan o transforman en otras,
manteniendose invariantes dos principios fundamentales :
El primero es el
principio de conservación de la materia que establece que la masa total del
sistema no varía. Este principio puede extenderse también al caso de la
conservación de la masa de aquellas sustancias químicas que no sufren reacción
química.
El segundo
principio es el de conservación de los elementos químicos que intervienen en el
sistema y que se asocian en las diferentes moléculas que constituyen las
sustancias químicas.
Finalmente cuando
en el sistema intervienen iones podríamos añadir un tercer principio que sería
el de electroneutralidad de cargas eléctricas o de igualdad de cargas positivas
y negativas.
Método. En general
para abordar un problema de balance de materia se pueden seguir los pasos que
se señalan a continuación :
1.- Interpretar
adecuadamente el enunciado del problema.
Conviene leer el
problema varias veces para comprenderlo y asimilarlo bien. Tratar de
identificar qué datos son conocidos y cuáles desconocidos. Si existe una o más
reacciones químicas involucradas o por el contrario no hay ninguna. Si se
conocen bien todas y cada una de las sustancias químicas que intervienen
(elementos químicos y fórmulas de las moléculas) y que cambios pueden sufrir en
las condiciones a que van a ser sometidas.
Se presupone
siempre que las condiciones son estacionarias, es decir, independientes del
tiempo y que no existe acumulación de masa en los equipos del proceso, de
manera que la entrada de materia tiene que ser igual a la salida conservándose
los principios que se indicaron más arriba.
Es preciso
desarrollar el sentido común y los conocimientos de química para aventurar
hipótesis correctas como por ejemplo que en toda combustión de una sustancia
orgánica a alta temperatura y con aire suficiente todo el carbono se convierte
en dióxido de carbono, todo el hidrógeno en agua, todo el azufre en anhídrido
sulfuroso y todo el nitrógeno en nitrógeno molecular. Se considera por lo
tanto, salvo indicación expresa, despreciable la formación de CO y de NOx.
Existen una serie
de datos implícitos que se consideran conocidos "a priori" como la
composición del aire (79% N2 y 21% O2) en el que se
asimilan los gases inertes contenidos en el aire por simplificación a
nitrógeno. La ecuación de estado de un gas perfecto PV = nRT, se supone válida
y general para cualquier gas, lo que permite que 1 mol de cualquier gas ocupe
22,414 litros en condiciones normales ( 1 atm y 0ºC o 273ºK). También debe
considerarse que toda composición gaseosa se expresa habitualmente en % en
volumen porque se suele analizar así, además por lo señalado antes el % molar y
el % volumétrico coinciden a cualquier presión y temperatura.
2.- Dibujar un
diagrama de flujo
En el que se
representen las corrientes de entrada y salida por flechas y las operaciones o
procesos como cajas rectangulares . En ellas tendrán lugar por ejemplo
reacciones químicas o procesos de mezcla o separación con una o varias entradas
y en general una o varias salidas a veces con distintas fases : líquida, sólida
o gaseosa.
3.- Colocar en
el diagrama los datos conocidos y desconocidos.
En las corrientes
de entrada y salida del diagrama de flujo se identifican las sustancias
químicas, fases y se indican las composiciones en caso de ser conocidas y las
cantidades de flujo de materia de las sustancias que sean datos en el problema.
4.- Colocar en
las cajas del diagrama las reacciones ajustadas y rendimientos de operación.
En caso de existir
una o varias reacciones se ajustarán y asignarán a los procesos
correspondientes así como su rendimiento o eficiencia tanto para aquéllas como
para los procesos de separación.
5.- Seleccionar
una base sencilla para los cálculos.
Dado que en
general las reacciones entre sustancias químicas proceden en general de forma
sencilla en moles ( número de veces en que está contenido el peso molecular de
la sustancia en gramos), resulta cómodo elegir 1 o 100 moles como referencia o
bien 1 o 100 Kmol del reactante principal o del más complejo si se conoce su
composición molar, como base de cálculo.
6.-
Inspeccionar el diagrama y leer de nuevo el enunciado.
Conviene de nuevo
identificar las sustancias químicas y las corrientes del proceso y comprobar
las composiciones y datos conocidos y desconocidos o sujetos a alguna condición
particular.
Técnicas de solución. Enlazando con el método anterior
se seguirían los pasos siguientes :
7.- Desarrollar
un balance de materias parcial o total
Para cada elemento
químico o sustancia que no reacciona se puede establecer un balance que iguale
la entrada a la salida. Para ello conviene empezar con las sustancias más
fáciles, es decir, aquellas que estén en una sola fase o una corriente única o
bien que no reaccionen como sucede con los componentes inertes, cenizas etc.
Por ejemplo el balance de nitrógeno en los procesos de combustión de
hidrocarburos con aire, permite relacionar rápidamente las corrientes de
entrada y salida.
Aunque normalmente
se puede plantear los balances de muchas maneras, una solución muy frecuente es
hacerlo como ecuación matemática por elemento químico que iguale la suma de moles
de entrada de cada sustancia que contenga el elemento en cuestión a la suma de
moles de sustancias de salida que contengan dicho elemento, en ambos casos se
afectará a cada sustancia de un factor dado por el número de veces que el
elemento aparezca en la molécula.
Cuando existe un
exceso de reactante, puede ser conveniente calcular la cantidad que queda
después de la reacción por diferencia entre el valor inicial y la cantidad que
ha reaccionado de acuerdo con la estequiometría de las reacciones que tengan
lugar.
8.- Resolución
del sistema de ecuaciones.
El sistema de
ecuaciones expresado por los balances elementales se resolverá por los métodos
habituales de resolución de sistemas de ecuaciones líneales (p.ej. método de
eliminación de Gauss).
9.- Comprobar
que la solución es lógica y no hay errores.
Mediante la
realización de un balance global de materia se puede comprobar que las masas
totales entrante y saliente son iguales. Esta condición es redundante y
combinación lineal de la suma de todos los balances elementales pero puede
servir de prueba de que no hay errores.
Asimismo conviene
desconfiar de los resultados obtenidos muy pequeños o muy grandes.
Ejemplo. Resulta
más sencillo referirse al método y técnicas de solución mediante un ejemplo.
Se quema 1 Kmol de
metano en un horno con un 20% de exceso de aire. Determinar la composición de
los humos en % base seca.
1.- El metano es
un gas a temperatura ambiente, si se quema con aire suficiente se convierte en
CO2 y H2O. En la salida que serán los humos aparecerá por
lo tanto CO2 , H2O, N2 y O2 por
haber aire excedente. No aparecerá el metano CH4 porque la reacción
con aire suficiente se considera completa. El exceso se supone siempre sobre la
cantidad estequiométrica.
2, 3, 4.- Se
dibuja el diagrama colocando datos y reacciones :
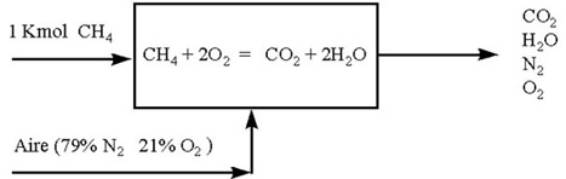
5, 6.- La base más
cómoda de cálculo está en el enunciado y es 1 Kmol de CH4.
7.- Existe una
condición particular que liga el oxígeno estequiométrico con el aire total que
entra (exceso del 20%) :
Oxígeno
estequiométrico : 2 Kmol ya que la reacción requiere 2 moles de oxígeno por mol
de metano.
Aire necesario de
entrada : 2·1,2/0,21 Kmol.
Resulta cómodo
calcular el oxígeno que sale por diferencia entre el que entra y el que ha
reaccionado :
O2 a la
salida Kmol = 2·1,2 - 2 = 0,4 Kmol.
Balance de
Carbono :
A la entrada : CH4
: 1 Kmol = CO2 a la salida. Por lo tanto CO2 = 1 Kmol.
Balance de
Nitrógeno :
A la entrada 2·
1,2·0,79/0,21 Kmol = N2 a la salida.
Balance de
Hidrógeno :
A la entrada
(1Kmol CH4) · 4 = H2O ·2 en salida
H2O = 2
Kmol en la salida, aunque al pedir la composición en base seca no es necesaria.
8.- La composición
molar queda :
CO2 : 1·100/(0,4
+ 1 + 9,02) = 9,59 %
N2 :
9,02·100/(0,4 + 1 + 9,02) = 86,57 %
O2 :
0,4·100/(0,4 + 1 + 9,02) = 3,84 %
9.- Comprobación :
Masa a la entrada
: 1 Kmol CH4 · 16 + 2,4 Kmol O2 · 32 + 2,4 · 0,79/0,21
Kmol N2· 28 = 345,6 Kg.
Masa a la salida :
1 Kmol CO2 · 44 + 2,4 · 0,79/0,21 Kmol N2· 28 + 0,4 Kmol
O2 · 32 +
2 Kmol H2O
· 18 = 345,6 Kg
El resultado es
por consiguiente correcto.
Alimentación
: Corriente de entrada a un
proceso o una planta.
Base seca : Se refiere a una mezcla exenta de agua. Generalmente
se usa para indicar que en la composición de una mezcla de sustancias químicas
en la que puede estar presente el agua, se excluye ésta como si no existiera y
no se analiza ni determina su proporción en la mezcla.
Composición
en peso : % en masa de cada
sustancia química en una mezcla. (gramos en 100 gramos)
Composición
molar : % en moles de cada
sustancia química en una mezcla. (moles en 100 moles)
Composición
volumétrica : % en volumen de
cada sustancia química en una mezcla. (litros en 100 litros)
Composición
elemental : % en peso de cada
elemento químico en una sustancia química o mezcla.
Consumo
específico : Cantidad necesaria
de una materia prima para obtener un producto final. Se suel expresar en Kg por
Kg o Kg por tonelada de producto. Si la cantidad es la mínima teórica necesaria
se trata de un consumo estequiométrico.
Consumo
estequiométrico : Cantidad de
materia prima mínima teórica necesaria para obtener una unidad de masa de
producto. Se determina por la relación de pesos moleculares de materia prima a
producto afectados de los coeficientes de la reacción ajustada.
Conversión : Sinónimo de rendimiento de una reacción química.
Defecto de
reactante : Señala que un
reactante se encuentra por debajo del consumo estequiométrico, por lo que la
reacción no se podrá verificar completamente.
Eficiencia : Sinónimo de rendimiento.
Eficacia : Sinónimo de rendimiento.
Estequiometría : La estequiometría es la ciencia que estudia las relaciones
cuantitativas en las reacciones químicas. Expresa con rigor las cantidades
exactas de cada molécula que se combinan entre sí o con otras para formar una
cantidad determinada de otra u otras moléculas. Las cantidades son
proporcionales a los pesos moleculares de las moléculas que intervienen
multiplicados por números enteros sencillos que son los coeficientes de la
reacción ajustada.
Exceso de
reactante : Cantidad añadida por
encima del consumo estequiométrico para garantizar que la reacción se completa
totalmente. Se suele expresar como porcentaje del consumo estequiométrico y
para obtener el consumo específico se suma al valor estequiométrico.
Materia
prima : Sustancia química de
partida para una operación o proceso.
P/p : Relación peso a peso. Equivalente a composición en
peso.
Producto : Salida de un proceso o planta de fabricación objeto
de la misma. También se dice de las sustancias a la derecha de una reacción
química.
Purga : Corriente de salida que se emplea para sacar fuera
de un sistema de reacción con alimentación, recirculación y separación, los
contenidos de sustancias inertes o subproductos que de otro modo se irían
concentrando en el circuito bloqueando la reacción.
P/v : Relación peso a volumen. Composición expresada como
masa sobre volumen total. Por ejemplo mg/l.
Reacción
ajustada : Reacción química en
forma de ecuación de reactantes igual a productos en la que cada uno de los
elementos químicos a izquierda y derecha de la ecuación coinciden, así como las
cargas eléctricas si las hubiera.
Reactantes : Sustancias químicas a la izquierda de la ecuación
de una reacción química.
Reactivo
limitante : Reactante que se
encuentra en menor proporción estequiométrica respecto a los demás en una
reacción química. Su desaparición señalaría el máximo rendimiento alcanzable :
100%.
Recirculación
: Corriente conteniendo materias
primas incompletamente reaccionadas que se mezcla con alimentación nueva para
volver a reaccionar en el reactor.
Rendimiento : Proporción generalmente porcentual en que ocurre
una reacción considerando como 100% la transformación de todos los reactantes
estequiometricamente en productos. También se usa para referirse a la extensión
de un proceso de separación. La diferencia a 100 corresponderá al porcentaje de
reactante que sale sin reaccionar o que reacciona de otra manera, en otra
reacción o en el caso de una separación, al componente que no se separa del
todo permaneciendo en la corriente inicial.
Selectividad : En el caso de múltiples reacciones, la relación
entre los moles de producto principal deseado, y los moles de subproducto
producido simultáneamente en el proceso.
Subproducto : Producto secundario o lateral, a veces no deseado,
pero en ocasiones inevitable, que se fabrica en la misma planta o proceso
químico a la vez que el producto principal.
V/v : Relación volumen a volumen. Equivalente a
composición volumétrica o en volumen.