Existen tres
métodos distintos de poder realizar este ejercicio. Te aconsejamos que
veas los tres.
![]() Método primero
Método primero ![]() Método segundo
Método segundo ![]() Método tercero
Método tercero
Método Primero
Apartado
a :
Hemos de
reconecer en el enunciado que partimos de dos electrodos de hidrógeno,
en los que se pueden dar los procesos ![]() ,
y que en principio son idénticos (misma
,
y que en principio son idénticos (misma ![]() ,
mismo volumen). Uno de ellos se modifica por la reacción :
,
mismo volumen). Uno de ellos se modifica por la reacción :
![]()
(ya que podemos
despreciar la contribución del ácido débil, ![]() )
)
Dado que tenemos
dos electrodos que se diferencian únicamente en la [H+], podemos decir
que se trata de una pila de concentración. Funcionará hasta que
se alcance el equilibrio, esto es , hasta que se igualen las [H+].
Además el
modificado (menor [H+])actuará como ánodo ; la
oxidación permitirá aumentar la [H+].
Procesos :
|
Ánodo
(modificado) |
|
|
Cátodo (no
modificado) |
|
|
Global |
|
Notación
de pila
![]()
Apartado
b :
Empleando red :
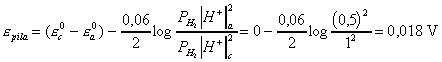
Apartado
c :
Cuando deja de
funcionar ![]() Dado
que los volúmenes son iguales y que, lógicamente, debe circular
la misma carga por ambos electrodos, podemos decir :
Dado
que los volúmenes son iguales y que, lógicamente, debe circular
la misma carga por ambos electrodos, podemos decir :
![]()
pH = 0,12
Método Segundo
Partimos
también de reconocer en el enunciado los dos electrodos diferentes.
Justificamos el funcionamiento de la pila de igual manera que lo hacemos en
todas. Esto es, la pila funciona porque la tendencia a reducirse (o a oxidarse)
es diferente en ambos electrodos : el de mayor red actuará como
cátodo. Calculamos red para cada electrodo.
Proceso de
reducción 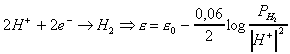
Modificado :
![]()
(Suponiendo, por
ejemplo ![]() .
El resultado no depende de esta suposición, pues
.
El resultado no depende de esta suposición, pues ![]() es
igual en ambos electrodos)
es
igual en ambos electrodos)
No
Modificado :
![]() cátodo.
cátodo.
Este resultado
nos permite asegurar que la notación de pila y ![]() ,
son los calculados en el procedimiento 1 (
,
son los calculados en el procedimiento 1 (![]() ).
).
Para calcular el
pH final hemos de considerar que![]() =0
cuando deje de funcionar
=0
cuando deje de funcionar
![]()
( igual que en el
procedimiento anterior)
Método Tercero
Partiendo
también del reconocimiento de ambos electrodos, puede realizarse una
proposición de pila, a evluar después, sin considerar previamente
cuál debe ser el ánodo o el cátodo. Podemos suponer, por
ejemplo, que la pila es :
![]()
Para esta pila
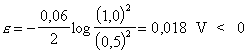
Este resultado
indica que esta suposición es incorrecta, y que la notación de
pila correcta es la inversa, a la que corresponde ![]() ,
obteniéndose así los mismos resultados que en los procedimientos
anteriores. El pH final se calcula de la misma forma que en el procedimiento 2.
,
obteniéndose así los mismos resultados que en los procedimientos
anteriores. El pH final se calcula de la misma forma que en el procedimiento 2.